|
|
 |
|
|
|
 |
| |
|
|
 |
Alta Atmósfera
Bases
|
Clorofluoro carbonos CFC y el agujero del ozono
La historia del agujero de la capa de ozono es un buen ejemplo de cómo un compuesto químico aparentemente inofensivo puede convertirse en un peligro para la vida en la Tierra, y cómo los gobiernos, la industria y la sociedad civil pueden trabajar en común para identificar y resolver el problema.
|
|
|
|
|
 |
|
De esta manera entendemos que cualquier perturbación que el hombre produzca en el sistema climático pueda desestabilizar el equilibrio natural de manera inesperada, y que si la comunidad mundial trabaja para alcanzar un objetivo común, los problemas medioambientales globales pueden ser controlados de forma efectiva.
Los CFCs son unas sustancias químicas que junto con muchas otras deterioran la capa de ozono, pero son los más importantes.
|
Usos y propiedades de los CFCs
Los clorofluorocarbonos son compuestos de carbono halogenados (hidrocarburos cuyos hidrógenos han sido sustituídos por halógenos) como el CFCl3 o el CF2Cl2, que comercialmente se conocen con el nombre de FREON, aunque en realidad esto es una marca. Los CFCs han sido utilizados en una gran variedad de procesos de manufactura y en forma de productos muy diversos: como refrigerante, disolvente en la industria electrónica, en procesos de fundición y formación de espumas, aerosol , extintor de incendios, agente desecante, desengrasante, como compuesto clave para la fabricación de espuma rígida aislante de casas u otras aplicaciones dentro de los hogares y como material de empaquetado aislante.
La sencilla razón por la que los usamos es porque no afectan a la salud humana, ya que los gases son totalmente inertes. No reaccionan con ningún compuesto natural ni en nuestro cuerpo ni en la troposfera. Por ello tienen una larga vida y se acumulan en el aire. La propiedad fundamental de estos compuestos que no se tuvo en cuenta en un principio es que son fotolizados por la radiación UV que emite el sol.
|
 |
 |
 |
|
1. El uso de los CFCs
Información del US Environmental Protection Agency (EPA)
|
|
 |
 |
|
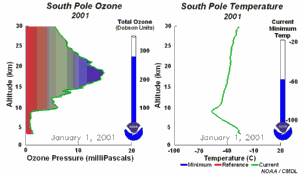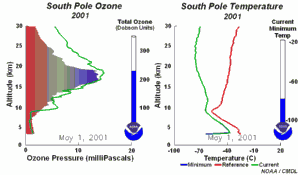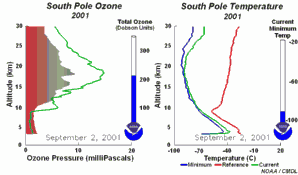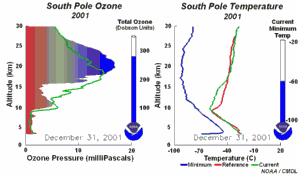
2. El desarrollo del agujero de la capa de ozono 2001
¡Pincha aquí para ampliar una secuencia de 5 días (270 K)!
Animación original proporcionada por el NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado
|
|
 |
El destino estratosférico de los CFCs
Como la intensa radiación solar UV-B es bloqueada por la capa de ozono en la estratosfera, la radiación UV que alcanza la troposfera es demasiado débil como para degradar significativamente los CFCs. Sin embargo este proceso sí tenía lugar cuando los CFCs penetraban lentamente en la estratosfera.
La descomposición conduce a la formación de radicales de cloro y flúor; pero esto no se traduce en una fuerte destrucción de ozono, puesto que los compuestos de cloro,que son responsables principales de la rotura del ozono, también sufren reacciones que dependen de las condiciones climáticas. Aunque el ozono estratosférico es reducido a otras latitudes, el agujero de la capa se forma únicamente en las regiones polares, en particular sobre la Antártida y sólo durante la primavera. ¿Por qué razón?
|
La reacción química
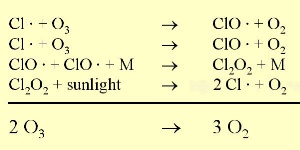
El ozono se encuentra en equilibrio en la capa de ozono, formándose y descomponiéndose debido a la radiación UV. Los radicales de cloro (Cl ) son catalizadores que a través de una reacción en cadena conducen a la reducción del ozono. Son muy eficientes en la descomopsición del ozono, puesto que no se consumen en la reacción sino que son reciclados y pueden volver a actuar. ) son catalizadores que a través de una reacción en cadena conducen a la reducción del ozono. Son muy eficientes en la descomopsición del ozono, puesto que no se consumen en la reacción sino que son reciclados y pueden volver a actuar.
|
 |
 |
 |
|
3. Reacción del ozono con el cloro. Los puntos indican que los compañeros de reacción son radicales.
Tamaño completo: 35 K
|
|
Las condiciones
La descomposición de los CFCs, después de sucesivas reacciones, lleva a la obtención de radicales de (Cl ), los cuales reaccionan con dióxido de nitrógeno NO2 y forman ClONO2, o con monóxido de nitrógeno NO y metano y forman HCl, y de la reacción ClONO2 con HCl también ácido nítrico HNO3. No entraremos en la química detallada, pero es importante saber que ambos productos ( HCl y ClONO2) son compuestos bastante estables y no reaccionan con el ozono. Únicamente unas condiciones concretas son capaces de producir radicales reactivos que son los causantes del agujero del ozono. Tras el descubrimiento del agujero del ozono en 1985 en la estación de investigación británica Halley Bey de la Antártida, los científicos tardaron entre dos y tres años en descubrir y comprender cuáles eran estas complejas condiciones. ), los cuales reaccionan con dióxido de nitrógeno NO2 y forman ClONO2, o con monóxido de nitrógeno NO y metano y forman HCl, y de la reacción ClONO2 con HCl también ácido nítrico HNO3. No entraremos en la química detallada, pero es importante saber que ambos productos ( HCl y ClONO2) son compuestos bastante estables y no reaccionan con el ozono. Únicamente unas condiciones concretas son capaces de producir radicales reactivos que son los causantes del agujero del ozono. Tras el descubrimiento del agujero del ozono en 1985 en la estación de investigación británica Halley Bey de la Antártida, los científicos tardaron entre dos y tres años en descubrir y comprender cuáles eran estas complejas condiciones.
|
 |
 |
|
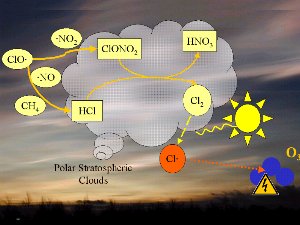
4. La química de las nubes estratosféricas polares conduce a la formación de los peligrosos radicales de cloro Cl (rojo).
¡Pincha aquí para ampliar (100 K)!
|
|
 |
1) Uno de los factores es la temperatura extremadamente baja de la estratosfera de aproximadamente -80°C, que puede llegar a ser menor en la Antártida durante la noche polar. Mientras se dan estas condiciones el ácido nítrico forma nubes estratosféricas de hielo, que no son estables si aumentan las temperaturas. En la superficie de estas nubes de hielo el HCl y ClONO2 reaccionan entre sí y forman ácido nítrico y cloro puro Cl2.
2) El cloro Cl2 es una molécula estable y no reacciona con el ozono, pero es fácilmente fotolizado por la luz solar y se descompone en 2 radicales de Cl , que atacan al ozono ( flecha naranja). , que atacan al ozono ( flecha naranja).
|
Tal y como hemos visto arriba, es el radical de cloro Cl el agente que conduce a la reducción del ozono. Esto no ocurre antes de que la radiación solar esté disponible para la división, como ocurre en la primavera de la Antártida. Por ello el agujero del ozono se observa cada año en la misma época en Septiembre y en Octubre. La reacción en cadena se mantiene siempre y cuando el resto de reactivos de las nubes de hielo sigan descongelándose y los radicales de Cl se eliminen en otras rutas. se eliminen en otras rutas.
|
 |
 |
 |
|
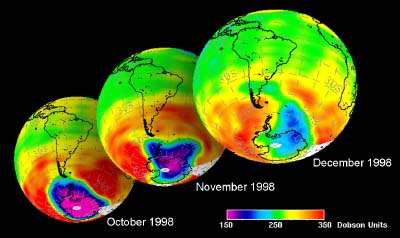
5. El desarrollo del agujero del ozono en la primavera de la Antártida 1998
datos del GOME
|
|
 |
 |
|
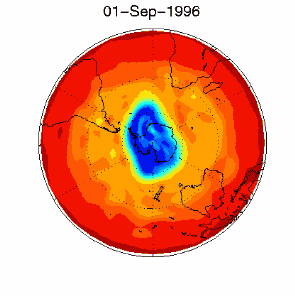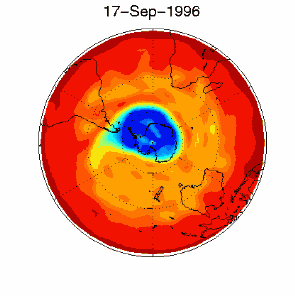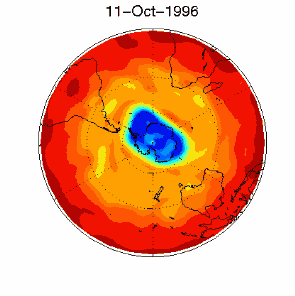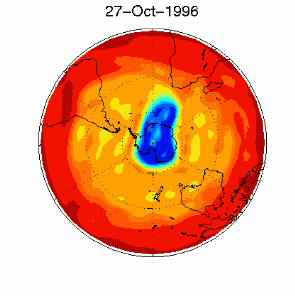
6. The ozone hole in the polar vortex over Antarctica in September / October 1996
adopted from UKMO data set, published at Brown University
Please click for higher resolved version (330 K)!
|
|
 |
3) El proceso completo no debería ser tan dramático y no debería afectar a la zona polar de la capa de ozono entre los 14-22km de altitud, porque el compuesto fuente de ClO se forma normalmente a altitudes mayores. Es necesario un transporte descendente por parte del viento en la estratosfera que lleve el ClO se forma normalmente a altitudes mayores. Es necesario un transporte descendente por parte del viento en la estratosfera que lleve el ClO hasta regiones más bajas. Esto sólo ocurre en lo que se conoce como vorágine polar (vortex polar). Aquí se dan las condiciones meteorológicas especiales en una especie de viento circupolar alrededor de la Antártida. hasta regiones más bajas. Esto sólo ocurre en lo que se conoce como vorágine polar (vortex polar). Aquí se dan las condiciones meteorológicas especiales en una especie de viento circupolar alrededor de la Antártida.
Como puede apreciarse, las condiciones para el agujero de la capa de ozono ( temperaturas muy bajas durante la noche polar, formación de nubes de hielo, la vorágine polar o vortex polar, junto con el amanecer polar) son tan especiales que, de no haberse observado, este proceso nunca habría sido pronosticado por los científicos.
|
El futuro del agujero del ozono
CFCs están por el momento prohibidos a escala global ( Protocolo de Montreal de 1987 sobre las sustancian que dañan a la capa de ozono y posteriores enmiendas). Debido a su larga vida, se tardarán unos 50 años hasta que los CFCs emitidos hasta ahora se pierdan en la estratosfera y el equilibrio del ozono se restaure. Se asume que en el año 2000 se ha alcanzado el máximo del agujero de la capa, y en los últimos años se ha mantenido con un tamaño bastante estable. Sin embargo, siempre existen excepciones. En el 2002 no se ha observado un agujero sigificativo; la razón es sencilla: Fue un año demasiado caliente, y el vortex polar no se formó como suele hacerlo. Una vez más se demuestra que los procesos atmosféricos a veces son independientes a cualquier predicción.
Pero en el 2003 el agujero apareció otra vez del tamaño habitual, llegando a ser el segundo más grande que se ha observado nunca.
|
 |
 |
 |
|
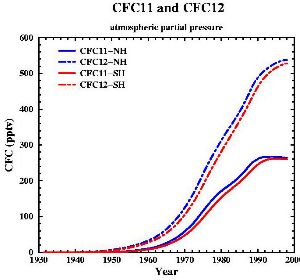
7. Desarrollo de las concenrtaciones de los 2 CFCs más importantes ( también llamados FREON 11 y FREON 12).
datos de : Walker et al., J. Geophys. Res., 105, 14,285-14,296, 2000 [internet plots]; ilustración de: Gian-Kasper Plattner (Univ. of Bern, UCLA)
|
|
Sobre esta página:
autor: Elmar Uherek - MPI Mainz
1. supervisor científico: Dr. Rajendra Shende, Head Energy and Ozone Action, United Nations Environment Programme 10-06-2003
2. supervisor científico: Dr. John Crowley - MPI for Chemistry, Mainz 05-06-2004
supervisor pedagógico: Hendrik Förster & students, Nordpfalz Gymnasium Kirchheim-Bolanden - Marzo 2004
última publicación:22-06-2004
|
|
 |
|







