|
|
 |
|
|
|
 |
| |
|
|
 |
Basse atmosphère
Plus |
Les techniques de mesure - la spectroscopie
La plupart des gaz traces dans l'atmosphère se trouvent, par définition, en quantités très faibles. Comment connaissons-nous leur concentration exacte? Quelles techniques de mesure sont utilisées?
|
|
|
|
|
 |
|
Lorsqu'on analyse de l'air, soit au laboratoire soit directement sur site, on se sert principalement de deux techniques de mesure différentes:
a) la spectroscopie - qui utilise les différentes interactions des molécules avec la lumière
b) la chromatographie - qui utilise les différentes interactions des molécules entre elles
|
 |
 |
|
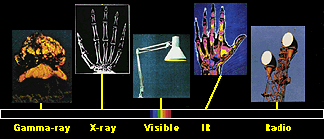
1. Le spectre électromagnétique comprend plusieurs sortes d'ondes électromagnétiques d'énergies différentes. La plupart sont très utiles pour observer l'atmosphère et connaître sa composition.
source et autres informations sur le spectre électromagnétique :  NASA NASA
|
|
 |
Les caractéristiques du rayonnement
On voit dans la vie de tous les jours qu'il y a beaucoup d'ondes électromagnétiques dans l'air, ayant différentes énergies : radios, micro-ondes, cabines à bronzer, rayons X pour la médecine, etc... Seule une partie de ces ondes est visible sous forme de lumière. L'ensemble de ces ondes, visibles ou non, forment ce qu'on appelle le spectre électromagnétique. Leur énergie est croissante suivant cet ordre: ondes radio, micro-ondes, infrarouges, lumière visible, ultraviolets, rayons X. Plus leur longueur d'onde est courte, plus haute seront leur fréquence et leur énergie. La plupart de ces ondes interagissent avec les molécules qui se trouvent dans l'air et d'après la façon dont elles réagissent, on peut identifier les molécules se trouvant dans l'air.
|
|
Longueur d'onde, fréquence et énergie des différentes parties du spectre électromagnétique :
|
|
Longueur d'onde (m) |
Fréquence (Hz = s-1) |
Energie (J) |
|
Radio |
> 1 x 10-1 |
< 3 x 109 |
< 2 x 10-24 |
|
Micro-onde |
1 x 10-3 - 1 x 10-1 |
3 x 109 - 3 x 1011 |
2 x 10-24- 2 x 10-22 |
|
Infrarouge |
7 x 10-7 - 1 x 10-3 |
3 x 1011 - 4 x 1014 |
2 x 10-22 - 3 x 10-19 |
|
Visible |
4 x 10-7 - 7 x 10-7 |
4 x 1014 - 7.5 x 1014 |
3 x 10-19 - 5 x 10-19 |
|
UV |
1 x 10-8 - 4 x 10-7 |
7.5 x 1014 - 3 x 1016 |
5 x 10-19 - 2 x 10-17 |
|
rayons X |
1 x 10-11 - 1 x 10-8 |
3 x 1016 - 3 x 1019 |
2 x 10-17 - 2 x 10-14 |
|
rayons gamma |
< 1 x 10-11 |
> 3 x 1019 |
> 2 x 10-14 |
|
Interaction entre la lumière et les molécules
Lorsqu'une onde électromagnétique rencontre sur son chemin aérien une molécule, elle va la modifier. Elle peut la faire tourner, ce qui demande peu d'énergie, faire bouger les liaisons qui lient les atomes entre eux dans la molécule ou même déplacer les électrons qui tournent autour du noyau (ceci nécessite beaucoup plus d'énergie). Tout ceci dépend des atomes qui composent la molécule, de sa taille et de la force des liaisons entre les atomes. Ainsi, lorsqu'on envoie un rayon électromagnétique dans l'air, et qu'on le compare avant et après avoir traversé l'air, on peut voir que certaines parties du rayon sont manquantes car elles ont été absorbées par les molécules. D'après les caractéristiques de l'absorption, on peut en déduire quelles molécules se trouvaient dans l'air et en quelle quantité.
|
|
|
 |
Supposons qu'avec une source on envoie des infrarouges (S) de différentes énergies (E) à travers une cuve contenant de l'air, et qu'on mesure quelle fraction de la lumière parvient jusqu'au détecteur (D). Les différentes énergies (donc différentes longueurs d'onde) sont indiquées ci-contre avec des couleurs rouges plus ou moins foncées.
|
|
|
 |
Une molécule donnée, se trouvant sur le trajet, absorbe les infrarouges qui ont une certaine énergie (par exemple ici, 2 rayons sur les 6 sont absorbés). Cette partie des rayons infrarouges n'atteint pas le détecteur. En soustrayant le spectre d'origine (sans la molécule pour intercepter) avec le deuxième, on obtient ce qu'on appelle un pic d'absorption, qu'on voit à doite. Le pic représente les infrarouges absorbés, et plus il y a de rayons absorbés (donc plus il y a de molécules) et plus le pic est élevé (voir figure 2d).
|
 |
 |
|
2. a-c) Animations par Elmar Uherek
Cliquez pour agrandir ! (30 K)
|
|
 |
Il peut se trouver sur le trajet lumineux une autre molécule qui absorbe aussi la lumière, mais une autre partie du spectre. On obtient alors un pic d'absorption pour une autre partie du spectre, correspondant à une énergie et une longueur d'onde différente.
|
 |
 |
|
2. d) Sur cette figure nous avons zoomé dans une partie du spectre (d'ailleurs les flèches ont toutes la même couleur), par exemple en regardant de près ce qui se passait pour la première molécule. Le fait qu'il arrive moins d'infrarouges sur le détecteur signifie qu'il y a eu plus de molécules pour faire obstacle aux rayons. La hauteur du pic d'absorption augmentera avec le nombre de molécules.
|
|
 |
Grâce à cela, on récupère des informations pour savoir quelles molécules sont dans l'air (grâce à la position du pic d'absorption selon la longueur d'onde). Mais on peut savoir aussi combien de molécules sont dans l'air, grâce à la hauteur du pic qui varie en fonction du nombre de molécules. |
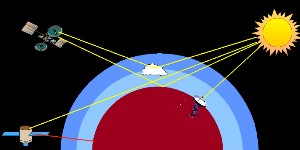
Il existe plusieurs possibilités pour mesurer l'absorption des ondes électromagnétiques dans l'atmosphère. On peut mesurer, sur Terre, l'absorption de la lumière qui provient du soleil ou de la lune (pour la partie visible et ultraviolets). Les satellites peuvent mesurer les infrarouges envoyés par la Terre. Ils peuvent aussi mesurer la lumière qui est réfléchie par la surface terrestre ou les nuages, ou la lumière solaire qui traverse l'atmosphère de façon tangentielle.
|
 |
 |
 |
|
3. les mesures d'absorption dans l'atmosphère par satellite
image par Elmar Uherek
|
|
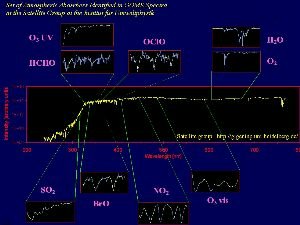
La Terre renvoie de la chaleur vers l'espace, sous forme de rayons infrarouges. De nos jours, cette température de la surface terrestre est mesurée par des satellites. Mais d'autres composés importants sont mesurés par les satellites, comme l'ozone. Un exemple de ces mesures est illustré par l'expérience GOME ( Global Ozone Monotoring Experiment). L'ozone n'est pas seul à être mesuré, les scientifiques observent aussi le NO2, l'eau, le SO2 et le formaldéhyde (HCHO).
|
 |
 |
 |
|
4. Spectre d'absorption de divers composés, pris par les instruments de l'expérience GOME embarqués sur satellelite.
source: Satellite group IUP Heidelberg
Cliquez pour agrandir ! (150 K)
|
|
 |
 |
|
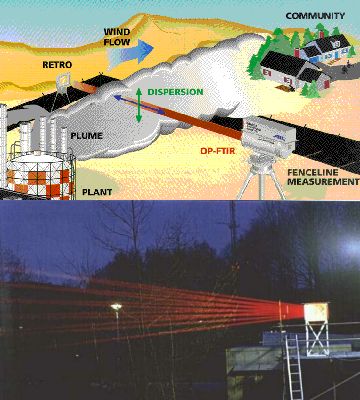
5. a+b) Attention: les rayons infrarouges sont invisibles à l'oeil nu. Ce qu'on voit ici sont en fait des rayons de couleur rouge que la source émet en même temps que les IR.
|
|
 |
La source de lumière et ke détecteur peuvent aussi se trouver tous deux au sol. Comme ils ne doivent pas être trop éloignés l'un de l'autre et que les concentrations des composés chimiques sont parfois faibles, on utilise un système complexe de miroirs: ceci permet de faire réfléchir plusieurs fois le rayon et d'augmenter ainsi artificiellement la longueur de son trajet dans l'atmosphère. L'image ci-contre montre un tel dispositif en théorie (image de EPA Field Analytik Technology Enyclopaedia) et en pratique (photo de FZ Jülich). C'est la spectroscopie infrarouge qui est utilisée ici; un exemple de spectre d'absorption est montré ci-dessous.
|
 |
 |
|
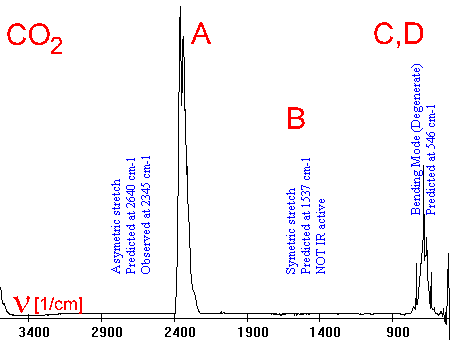
6. Voici un exemple du spectre infrarouge duCO2 , avec les vibrations de sa molécule. Le spectre peut parfois être compliqué, lorsque les pics d'absorption de différentes molécules se superposent, ou si les molécules sont elles-mêmes compliquées et que de multiples vibrations sont possibles.
Spectre et animations de : Scott Van Bramer,  Widener University Widener University
|
|
 |
Vibrations:
A Elongation asymétrique

B Elongation symétrique
[not IR active]

C déformation verticale

D déformation horizontale

|
|
A propos de cette page:
auteur: Dr. Elmar Uherek - MPI for Chemistry Mainz
relecteur scientifique: Dr. Mark Lawrence, MPI for Chemistry, Mainz, 2004-05-05
relecteur pédagogique: Michael Seesing - Uni Duisburg - 2003-07-02
dernière version: 2004-05-10 |
|
 |
|







