|
|
 |
|
|
|
 |
| |
|
|
 |
Untere Atmosphäre
Mehr .. |
Ozonreaktionen -Warum ist Ozon gefährlich?
Im Themenfeld 'Obere Atmosphäre' lernen wir, dass Ozon in der Stratosphäre wichtig ist, um uns vor Schäden durch UV-Licht zu bewahren. In unserer unmittelbaren Umgebung an der Erdoberfläche jedoch wollen wir es nicht haben. Welche Schäden aber richtet Ozon an?
|
|
|
|
|
 |
Ein bisschen wird benötigt
Es ist nun nicht richtig, dass wir gar kein Ozon in unserer Umgebung benötigen. Ein gewisse Menge wird benötigt, um das Hydroxyl-Radikal OH bilden zu können, wie in Einheit 1 'Oxidation und OH' beschrieben. Ohne OH könnte sich die Luft nicht selbst reinigen. Steigen die Ozon-Konzentrationen jedoch stark an, schädigt das Gas unsere Gesundheit und auch die Pflanzenwelt. In Schwimmbädern wird es manchmal sogar genutzt, um Bakterien zu töten. Was macht Ozon so aggressiv?
|
 |
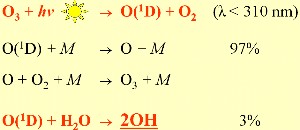 |
 |
|
1. OH-Bildung kann nur erfolgen, wenn etwas Ozon in der Luft ist
Schema: Elmar Uherek
Zum Vergrößern bitte anklicken!
|
|
 |
 |
|
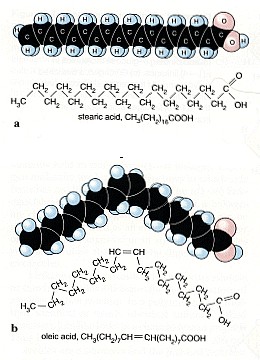
2. Nicht alle Fettsäuren haben Doppelbindungen. Manche sind auch gesättigt (a). Aber viele sind ungesättigt, d.h. sie haben eine C=C Doppelbindung.
Quelle: NTRC, Univ. of Texas Kingsville
|
|
 |
Ozon greift unseren Atemapparat an
Nach unserem ersten Schuljahr in organischer Chemie wissen wir, dass Kohlenstoff C und Wasserstoff H in allen lebendigen Organismen vertreten sind, in Pflanzen, in Tieren und auch in unserem Körper. Außer C und H können auch noch andere Elemente wie Sauerstoff O, Stickstoff N, Schwefel S und Phosphor P in den organischen Verbindungen auftreten. Kohlenwasserstoffe aus C und H bilden aber immer das Rückgrat. Dieses Rückgrat besteht aus C-C Einfachbindungen, die sehr stark sind, und C=C Doppelbindungen, die manchmal einfacher anzugreifen sind. Gerade für Ozon sind solche Doppelbindungen von Interesse. Wir finden sie überall, in ungesättigten Fettsäuren, im Blutfarbstoff Hämoglobin, in Proteinen und vielen anderen Biomolekülen. Wir finden sie auch in Verbindungen an der Oberfläche der Lungenbläschen und Schleimhäute in unserem Atemsystem.
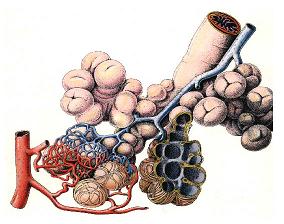
Die anderen beiden atmosphärischen Hauptoxidantien OH und NO3 haben eine extrem kurze Lebenszeit und reagieren sofort, wenn sie gebildet werden. Ozon jedoch schafft es hinunter bis in unsere Lungen. Jeden Tag strömen 20.000 Liter Luft durch die kleinen Lungenbläschen, die insgesamt eine Oberfläche von 80 - 100 Quadratmetern haben. Ozon kann hier eindringen und reagieren.
|
Ozon bricht Doppelbindungen
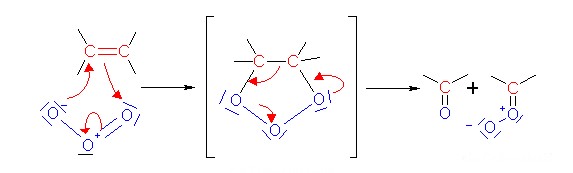
Ozon reagiert mit den Fettsäuren in den Lungen in derselben Weise wie mit Molekülen in der Luft. Es lagert sich an die Doppelbindungen an, bricht sie und erzeugt hierdurch aggressive Radikale, die zu weiterer Oxidation führen. Die Konsequenz ist eine Entzündung der Lungen, die insbesondere für Menschen mit Asthma gefährlich, aber auch für Gesunde schädlich ist. Die Aufnahmefähigkeit der Lunge sinkt, und die Atmung wird flach, wenn wir arbeiten. Man sollte keinen Sport treiben und harte körperliche Arbeit vermeiden, wenn die Ozon-Werte hoch sind.
|
 |
 |
 |
|
3. Die Bläschen in unseren Lungen (Alveolen) werden durch Ozon angegriffen.
© emphysem-info
|
|
 |
 |
|
4. Die Reaktion von Ozon mit Doppelbindungen (Ozonolyse) führt zu einem Bruch der Bindung.
Schema: Institut für Didaktik der Chemie, Universität Duisburg
|
|
Ozon bricht nicht nur Doppelbindungen von Molekülen in unseren Lungen. Es greift auch die Doppelbindungen von in der Natur freigesetzten Molekülen an, wie z.B. den Terpenen (Riechstoffe des Waldes) oder Bio-Molekülen an den Oberflächen von Pflanzen. Setzt man Blätter höheren Ozon-Konzentrationen aus, so erleiden auch sie Schäden. Mit sehr hohen Ozonkonzentrationen kann man sogar die Doppelbindungen im Gummi eines Luftballons 'zerschneiden' und den Ballon zum Platzen bringen.
|
|
In der Atmosphäre kann die Reaktion von Ozon mit organischen Gasen, wie sie zum Beispiel Wälder abgeben, zur Bildung von Partikeln führen. Dies ist in dem folgenden Film auf YouTube gezeigt:
|
About this page:
author: Dr. Elmar Uherek - MPI for Chemistry Mainz
scientific reviewer: Dr. Rolf Sander - MPI for Chemistry, Mainz 2004-05-18
last published: 2004-05-18
translation: Elmar Uherek - 2004-06-07
|
|
 |
|







