|
 Dall'anidride all'acido solforoso Dall'anidride all'acido solforoso
Quando l'anidride solforosa si scioglie in acqua forma una soluzione leggermente acida di l'acido solforoso.
H2O + SO2 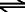 H2SO3 H2SO3
In acqua, l'acido solforoso forma ioni H+ (aq) e due anioni:
H2SO3 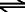 H+(aq) + HSO3-(aq) H+(aq) + HSO3-(aq)
L'acido solforoso forma un idrogenione ed un anione di solfito di idrogeno
HSO3-(aq) 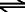 H+(aq) + SO32-(aq) H+(aq) + SO32-(aq)
Il solfito di idrogeno cede un protone ed un anione di solfito.
Da ogni molecola di acido solforoso vengono rilasciati due protoni. Pertanto, l'acido solforoso viene chiamato acido biprotico.
Tuttavia, l'acido solforoso è instabile infatti, già a temperatura ambiente, si decompone in anidride solforosa e acqua.
 Acido solforico Acido solforico
Con la combustione dello zolfo e durante le reazioni di ossidazione nell'aria si forma non solo anidride solforosa, ma anche anidride solforica. La quantità formata da ognuno di questi gas dipende strettamente dalla temperatura: infatti a temperature superiori ai 600°C l'anidride solforica si decompone in anidride solforosa ed ossigeno:
2 SO3 -> 2 SO2 + O2 (a t > 600°C)
Se l'anidride solforica si scioglie in acqua si forma acido solforico:
SO3 + H2O 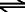 H2SO4 H2SO4
L'acido solforico è anch'esso un acido biprotico che si decompone in acqua formando due protoni ed un anione.
H2SO4 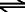 H+(aq) + HSO4-(aq) H+(aq) + HSO4-(aq)
In un primo stadio l'acido solforico forma un protone ed un anione di solfato di idrogeno.
HSO4-(aq) 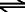 H+(aq) + SO42-(aq) H+(aq) + SO42-(aq)
Il solfato di idrogeno si decompone in un altro protone ed in un anione di solfato.
|







