|
|
 |
|
|
|
 |
| |
|
|
 |
Bassa Atmosfera
Approfondimento |
Tecniche di misura - spettroscopia
I gas in tracce sono presenti nell'atmosfera a concentrazioni molto basse. In questa sezione analizziamo la tecniche per misurare i livelli di tali gas nell'aria.
|
|
|
|
|
 |
|
I due metodi più comuni per l'analisi dei componenti atmosferici, in laboratorio o fuori, sono:
a) spettroscopia - basata su i diversi modi di interazione delle molecole con la luce
b) cromatografia - basata su i diversi modi in cui le molecole reagiscono tra di loro.
|
 |
 |
|
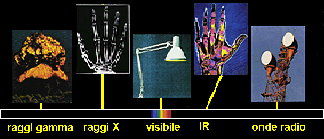
1. Lo spettro elettromagnetico è formato da diversi tipi di onde elettromagnetiche con diverse energie. Possiamo utilizzare la maggior parte di esse per studiare le caratteristiche e le concentrazioni di diverse molecole presenti nell'aria. Fonte e ulteriori informazioni sullo spettro elettromagnetico: provenienti dalla NASA.
|
|
 |
Le caratteristiche della radiazione
Utilizzando la radio, il forno a microonde, le lampade abbronzanti e sottoponendoci ad esami a raggi X abbiamo a che fare con tipi diversi di radiazione, ciascuno caratterizzato da diverse energie e di questi solo alcuni sono visibili come luce. Queste diverse forme di radiazione formano lo spettro elettromagnetico. La forma meno energetica è costituita dalle onde radio, seguite dalle microonde, dalla radiazione infrarossa, dalla luce visibile, dalla radiazione ultravioletta e dai Raggi X ed infine dai raggi gamma che sono i più energetici. All'aumentare dell'energia della radiazione, aumenta la frequenza e diminuisce la lunghezza d'onda. Quasi tutte le diverse forme di radiazione interagiscono con le molecole e, dal modo in cui lo fanno, possiamo identificare le specie chimiche presenti nell'atmosfera. |
|
Lunghezza d'onda, frequenza e energia delle diverse regioni dello spettro elettromagnetico:
|
|
Lunghezza d'onda (m) |
Frequenza (Hz = s-1) |
Energia (J) |
|
Onde Radio |
> 1 x 10-1 |
< 3 x 109 |
< 2 x 10-24 |
|
Microonde |
1 x 10-3 - 1 x 10-1 |
3 x 109 - 3 x 1011 |
2 x 10-24- 2 x 10-22 |
|
Infrarossa |
7 x 10-7 - 1 x 10-3 |
3 x 1011 - 4 x 1014 |
2 x 10-22 - 3 x 10-19 |
|
Visibile |
4 x 10-7 - 7 x 10-7 |
4 x 1014 - 7.5 x 1014 |
3 x 10-19 - 5 x 10-19 |
|
Ultravioletta |
1 x 10-8 - 4 x 10-7 |
7.5 x 1014 - 3 x 1016 |
5 x 10-19 - 2 x 10-17 |
|
Raggi X |
1 x 10-11 - 1 x 10-8 |
3 x 1016 - 3 x 1019 |
2 x 10-17 - 2 x 10-14 |
|
Raggi Gamma |
< 1 x 10-11 |
> 3 x 1019 |
> 2 x 10-14 |
|
Interazione di luce e molecole
Se una porzione di radiazione incontra una molecola presente nell'aria, può trasferire la sua energia e cambiare lo stato della molecola. Per far rotare la molecola è necessaria un'energia più bassa, mentre per far muovere i legami ne è necessaria di più e ancora di più per far muovere gli elettroni presenti a livelli energetici più elevati.
La quantità di energia trasferita dipende dalla molecola, dalla sua dimensione e da quanto forte è il legame tra gli atomi della molecola. Perciò, se facciamo attraversare l'atmosfera dalla radiazione e osserviamo come questa si modifica dopo aver interagito con la particella d'aria che stiamo osservando, vediamo che una frazione di radiazione è stata assorbita (consumate) dalle molecole. Dal carattere dell'assorbimento possiamo determinare il tipo e la concentrazione delle molecole presenti.
|
|
|
 |
Quindi cosa succede se facciamo emettere ad una sorgente (S) radiazione infrarossa a diverse energie (E) e le facciamo attraversare una particella d'aria e poi misuriamo quanta di quella radiazione raggiunge il rivelatore (D)? Le diverse energie (diverse lunghezze d'onda) sono indicate dalle diverse tonalità di rosso. |
|
|
 |
Una molecola presente nell'aria assorbe la radiazione emessa dalla sorgente ad una particolare energia (qui, due su sei delle diverse energie emesse dalla sorgente sono assorbite dalla molecola) impedendogli di raggiungere il rivelatore. Se sottraiamo lo spettro dell'energia emessa originariamente dalla sorgente a quella misurata dal rivelatore, otteniamo il picco di assorbimento mostrato sulla destra. Questo picco rappresenta la radiazione assorbita dalla molecola. Più luce viene assorbita, più alto diventa il picco.
|
 |
 |
|
2. a-c) Animazioni di Elmar Uherek
Cliccare per allargare! (30 K)
|
|
 |
Nell'atmosfera però può esserci anche un'altra molecola che assorbe la radiazione. I legami tra gli atomi in questa molecola sono tuttavia più forti ed è quindi necessaria più energia per farli muovere. Di conseguenza, il picco di assorbimento appare ad una diversa energia (lunghezza d'onda) dello spettro.
|
 |
 |
|
2. d) Diversamente dalle tre immagini precedenti, adesso ci focalizziamo su un intervallo di energia più piccolo (tutte le frecce hanno energie molto simili). Lo sbiadimento dei colori ci dice che arriva meno luce al rivelatore perché il numero di molecole presenti la radiazione incontra un numero di molecole crescente man mano che attraversa l’aria. Poiché il picco di assorbimento è la differenza tra la radiazione emessa dalla sorgente e la radiazione misurata dal rivelatore, il picco cresce in dimensione quando la quantità di radiazione che raggiunge il rivelatore diminuisce.
|
|
 |
Dalla posizione della banda di assorbimento otteniamo l'informazione su quali molecole sono presenti nell'aria. Dall'intensità della banda di assorbimento, possiamo determinare quante molecole ci sono nell'aria, perché la quantità di radiazione assorbita è proporzionale al numero di molecole presenti.
|
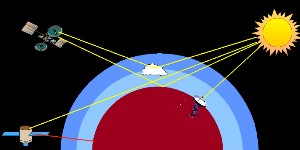
Ci sono diversi modi per misurare l'assorbimento della radiazione in atmosfera. Sulla Terra, possiamo misurare l'assorbimento della radiazione ultravioletta e visibile proveniente dal Sole o riflessa dalla Luna. Possiamo anche misurare la radiazione infrarossa emessa dalla superficie terrestre utilizzando i satelliti orbitanti nello spazio. Possiamo utilizzare i satelliti anche per misurare la quantità di radiazione solare riflessa direttamente dalla superficie terrestre, dalle nuvole o quella che attraversa tangenzialmente l'atmosfera terrestre.
|
 |
 |
 |
|
3. Misure dell'assorbimento nell'atmosfera basate su satelliti. Immagine di Elmar Uherek.
Cliccare per allargare!
|
|
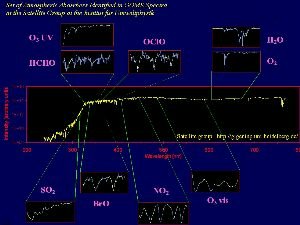
Con i satelliti è possibile non solo misurare la radiazione IR proveniente dalla superficie terrestre, ma anche la concentrazione di importanti composti inorganici come l'ozono, gli ossidi di azoto e gli ossidi di alogeni. Un esempio è l'Esperimento di Monitoraggio dell'Ozono Globale (GOME) che utilizza uno spettrometro sul satellite ERS-2 per misurare non solo ozono ma anche biossido di azoto, acqua, biossido di zolfo e formaldeide (HCHO) a lunghezze d'onda che vanno dall'ultravioletto, al visibile fino all'infrarosso (lunghezze d'onda da 240 a 790 nm).
|
 |
 |
 |
|
4. Spettri di vari composti inorganici nell'atmosfera, misurati dallo strumento GOME basato su satellite. Fonte: Satellite group, IUP Heidelberg. Cliccare per allargare (150 K).
|
|
 |
 |
|
5. Nota bene: la radiazione infrarossa non è visibile ai nostri occhi. Nella fotografia i fasci sono visibili perché la sorgente di luce non emette solo radiazione infrarossa
|
|
 |
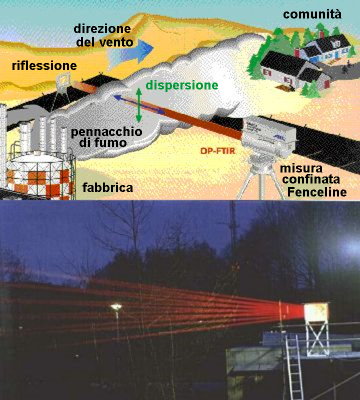
Possiamo fare misure simili anche dal suolo. Poiché le concentrazioni dei composti chimici a cui siamo interessati sono molto piccole, utilizziamo degli specchi per riflettere molte volte il fascio di radiazione prima che questo raggiunga il rivelatore. Questo significa che la radiazione attraversa molti chilometri di aria e quindi le molecole attraversate dal raggio sono sono abbastanza numerose da poter essere misurate.
L'immagine a sinistra mostra un allestimento teorico (immagine dalla EPA Field Analytik Technology Encylopaedia) e reale (foto del FZ Jülich). Qui è stata utilizzata una spettroscopia infrarossa e sotto è mostrato un semplice esempio del tipo di spettro registrato.
|
 |
 |
|
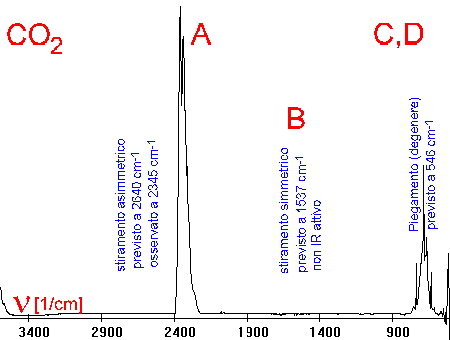
6. Questo semplice esempio mostra lo spettro infrarosso della CO2 insieme con le vibrazioni che vengono attivate. Gli spettri infrarossi possono essere piuttosto complicati se si sovrappongono gli assorbimenti di diverse molecole o se le molecole sono complesse e sono quindi possibili molte vibrazioni. Spettro e animazioni da Scott Van Bramer, Widner University.
|
|
 |
Vibrazioni:
A stiramento asimmetrico

B stiramento simmetrico
[non IR attivo]

C piegamento verticale

D piegamento orizzontale

|
|
Pagine collegate
Se sei interessato alle proprietà della luce, dai un'occhiata a:
Nuvole e Particelle - Principi - Unità 3 - Arcobaleni
Scopri di più sulle tecniche utilizzate per osservare l'atmosfera in:
Alta Atmosfera - Principi - Unità 1 - Osservazione
Aproposito di questa pagina:
Versione italiana: Laura Dini (traduttore) e Michela Maione (revisione linguistica)
autore: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz, Germany
revisione scientifica: Dr. Mark Lawrence - Max Planck Institute for Chemistry, Mainz - 2004-05-05
revisione didattica: Michael Seesing - Uni Duisburg, Germany - 2003-07-02
utlima pubblicazione: 2004-05-10
|
|
 |
|







