|
|
 |
|
|
|
 |
| |
|
|
 |
Bassa Atmosfera
Approfondimento |
1. Ossidanti e osservazione - approfondimento
Foglio di lavoro 2: la interrelazione tra luce, assorbimento e colore
|
|
|
|
|
 |
 |
 |
|
Figura 1: lo spettro della luce bianca.
© 2004 Seesing, Tausch; Universität Duisburg-Essen, Duisburg [Lit:Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993]
|
|
La luce visibile è solo una parte dello spettro della radiazione elettromagnetica. Consiste di minuscole unità di energia chiamate quanti di luce o fotoni. L'energia di un fotone è determinata dalla sua lunghezza d'onda. Se la stessa quantità di fotoni di tutte le lunghezze d'onda di uno spettro visibile raggiunge i nostri occhi, vediamo la luce come luce bianca. Anche un oggetto appare bianco se riflette nello spazio tutti i fotoni di energia diversa. Un oggetto appare nero se assorbe tutte le diverse lunghezze d'onda della luce.
Le diverse lunghezze d'onda della luce visibile possono essere separate con un prisma o reticolo di diffrazione (qualcosa con elevato numero di sottili linee parallele - se muovi un CD intorno nella luce, funziona come un reticolo di diffrazione e vedi tutti i diversi colori della luce). Lo spettro luminoso in uscita da un prisma mostra i colori ordinati in base alle loro energie (vedi Figura 1.).
Se una sostanza assorbe tutte le lunghezze d'onda della luce eccetto, per esempio, il rosso, le lunghezze d'onda rosse sono riflesse nello spazio e vediamo l'oggetto come se fosse di colore rosso. Se parte della luce di una certa energia è assorbita vediamo il colore complementare della luce assorbita.
|
|
|
C 1 |
Quale colore visibile appartiene ad ognuno degli spettri sottostanti? |
|
spettro |
colore risultante | |
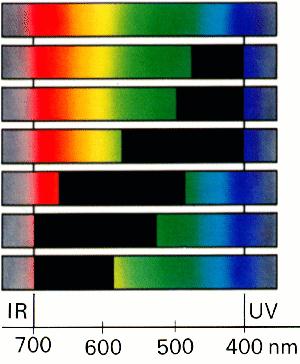 |
 |
|
© 2004 Seesing, Tausch; Universität Duisburg-Essen, Duisburg [Lit:Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993]
|
|
 |
|
|
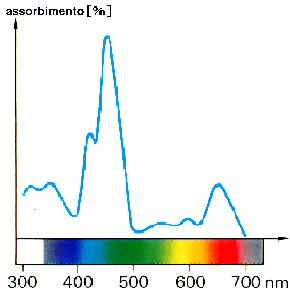
In natura molte cose appaiono colorate. La maggior parte assorbe in diverse aree dello spettro visibile. La quantità assorbita in ogni area non è di solito la stessa (Figura 2). Questo comporta spettri di assorbimento caratteristici che possono essere utilizzati per identificare diverse sostanze. Inoltre, due sostanze costituite dagli stessi componenti possono a volte avere diversa lucentezza.
|
|
C 2 |
Suggerisci un'ipotesi sul perché due campioni della stessa sostanza hanno diversa brillantezza e giustifica la tua idea. Disegna lo spettro di una clorofilla b "più scura" nella Figura 2. |
|
 |
 |
 |
|
Figura 2: spettro di assorbimento della clorofilla b
© Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993
|
|
Spettroscopia di base
La spettroscopia è una tecnica utilizzata per identificare diverse sostanze. Utilizzando in laboratorio uno spettrofotometro possiamo vedere gli spettri caratteristici delle diverse sostanze . Gli spettrofotometri sono anche installati sui satelliti che orbitano intorno alla Terra. Conoscendone lo spettro caratteristico, possiamo identificare dallo spazio le sostanze presenti nella nostra atmosfera.
Dai un'occhiata allo spettro dell'atmosfera creato dal satellite GOME nella pagina di ESPERE "Bassa Atmosfera - Approfondimento - 1. Ossidanti"
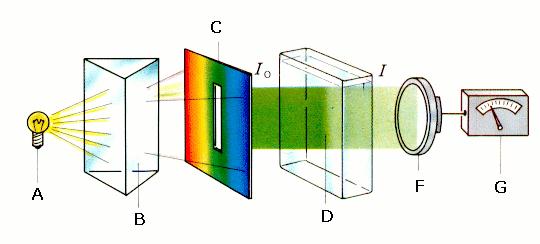
La figura 3. mostra di che cosa è fatto uno spettrofotometro.
|
 |
 |
|
Figura 3:
Schema a blocchi di un fotometro A: sorgente luminosa; B: monocromatore (prisma o reticolo di diffrazione); C: fessura; D: cuvetta contenente il campione; F: fotosensore; G: amplificatore con lettura calibrata che mostra l'ESTINZIONE; Io: intensità della luce prima del campione; I: intensità della luce dopo il campione. Il valore di ESTINZIONE misurato ci da il rapporto tra l'intensità della luce che è passata (I) attraverso il campione e l'intensità della luce originale (Io).
© 2004 Seesing, Tausch; Universität Duisburg-Essen, Duisburg [Lit:Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993].
|
In base all'apparecchio e a come è configurato, i valori misurati possono essere dati sotto forma di percentuale o logaritmica.
|
 |
|
|
In uno spettrofotometro ci sono molti parametri regolabili. Possono essere utilizzate diverse lampade, in particolar modo quando i campioni assorbono nella regione ultravioletta dello spettro elettromagnetico. La posizione del monocromatore può essere cambiata così come la larghezza della fessura. Questo permette di illuminare il campione con diverse lunghezze d'onda della radiazione. Anche la quantità del campione attraverso cui la luce passa (la lunghezza del percorso) può essere cambiata utilizzando cuvette di dimensioni diverse.
|
C 3 |
Cosa devi cambiare esattamente e di continuo per ottenere uno spettro come quello mostrato in Figura 2? Giustifica le tue risposte. | |
|
Gli scienziati Johann Heinrich Lambert (1728-1777) e August Beer (1825-1863) svilupparono una equazione fisica che è stata loro intitolata: la legge di Lambert-Beer:
|
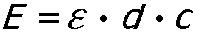 |
 |
|
dove: E: estinzione; å coefficente di estizione molare (costante che dipende dalle lunghezze d'onda e dal carattere della sostanza di assorbimento); d: lunghezza del percorso del campione; c: concentrazione della sostanza che assorbe
|
|
C 4 |
Utilizza i tuoi risultati di C2 e reinterpretali utilizzando la legge di Lambert-Beer. Quale proporzionalità relativa all'estinzione puoi ottenere sperimentalmente ed utilizzare? |
|
C 5 |
Discuti dei tuoi risultati di C3 e 4! |
|
|
A proposito di questa pagina:
Versione italiana: Laura Dini (traduttore) e Michela Maione (revisione linguistica)
autori: M. Seesing, M. Tausch - Universität Duisburg-Essen, Duisburg, Germany
revisione scientifica: Dr. Mark Lawrence - Max Planck Insitute for Chemistry, Mainz - 2004-05-05
ultimo aggiornamento: 2004-05-13
|
|
 |
|







