|
|
 |
|
|
|
 |
| |
|
|
 |
Bassa Atmosfera
Approfondimento |
Ossidazione nell'atmosfera
Molti composti chimici sono emessi nell'atmosfera ma i processi di rimozione ne impediscono l'accumulo. Alcune specie sono rimosse in seguito a deposizione secca di gas e particelle, oppure possono essere incorporate nella pioggia ed essere rimosse per deposizione umida. Per i composti chimici organici che si trovano allo stato gassoso la rimozione avviene normalmente per ossidazione che porta alla formazione di specie meno volatili, solubili nell'acqua.
|
|
|
|
|
 |
 |
 |
|
1. I radicali idrossile (OH) puliscono l'aria. Immagine: Elmar Uherek.
|
|
 |
L'ossidazione in senso chimico non significa necessariamente una reazione con composti che contengono ossigeno, è piuttosto la perdita di elettroni. Tuttavia, nell'aria, l'ossidazione coinvolge generalmente la reazione delle specie chimiche con un composto che contiene ossigeno.
Le tre specie ossidanti più importanti nell'aria sono:
il radicale ossidrile OH
il radicale nitrato NO3
la molecola di ozono O3
Anche i radicali idroperossidici (HO2) sono importanti e la somma di HO2 e OH è a volta indicata come HOx.
La specie ossidante più importante è il radicale ossidrile (OH). E' estremamente reattivo e capace di ossidare la maggior parte degli elementi chimici presenti nella troposfera. Il radicale ossidrile è perciò conosciuto come il 'detergente dell'atmosfera' .
|
Sono pochissimi i gas presenti in troposfera che non reagiscono affatto o reagiscono solo molto lentamente con il radicale ossidrile. Tra questi ricordiamo i clorofluorocarburi (CFC), il protossido di azoto (N2O) e l'anidride carbonica (CO2). La velocità di ossidazione del metano (CH4) con OH è anch'essa molto lenta, tra 100 e 1000 volte più lenta, rispetto a quella di altri composti organici. . Questo è il motivo per cui le concentrazioni di metano nella atmosfera hanno potuto raggiungere 1.77 ppm (1.77 µmol mol-1), un valore significativamente più elevato delle concentrazioni nell'atmosfera di altri gas organici in tracce che sono generalmente sotto 1 ppb (1 nmol mol-1)*.
|
 |
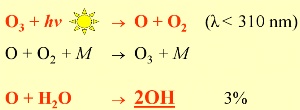 |
 |
|
2. La formazione di OH: Più del 97% degli atomi di O che si formano dalla fotolisi di ozono, reagisce nuovamente all'ozono. Meno del 3% avvia la formazione del più importante radicale atmosferico, OH. Se due molecole o atomi collidono per formare un prodotto, è necessaria una terza specie M per assorbire l'energia in eccesso. M (di solito azoto N2) non partecipa alla reazione.
Cliccare per allargare!
|
|
 |
 |
|
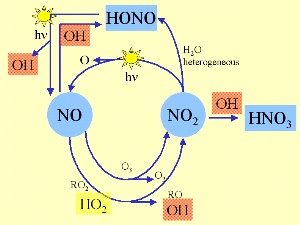
3. OH e il ciclo degli ossidi di azoto
Schema di Elmar Uherek
Cliccare per allargare (90 K)
|
|
 |
Come si forma OH?
OH governa la chimica dell'atmosfera durante il giorno in quanto la sua formazione dipende dalla radiazione solare. La reazione iniziale (mostrata sopra) coinvolge la rottura (fotolisi) dell'ozono attraverso la radiazione solare a lunghezza d'onda inferiore a 310 nm. L'atomo di ossigeno (O) così formatosi reagisce con l'acqua per formare OH. Questo meccanismo di reazione è il motivo per cui nella troposfera è necessaria una piccola quantità di ozono. Altre fonti di OH sono:
la fotolisi di acido nitroso (HONO), il perossido di idrogeno (H2O2) il perossimetano (CH3OOH) la reazione del monossido di azoto (NO) con il radicale idroperossidico (HO2) o la reazione degli alcheni con l'ozono.
Lo schema a sinistra mostra come la chimica di OH sia fortemente collegata al ciclo di reazioni diurno degli ossidi di azoto. |
Quanto OH si forma?
Poichè OH è un radicale estremamente reattivo reagisce non appena si forma. La sua emivita dura meno di un secondo. Questo significa che la sua concentrazione è estremamente bassa, in scala molecolare abbiamo da 1x105 a 2x107 molecole cm-3. Alla pressione del livello del mare questo equivale a un rapporto di mescolamento di 0.01 - 1 ppt (pmol/mol). Solo una su 1000 - 100,000 miliardi di molecole nell'aria è OH. Poiché la sua formazione dipende dal vapore acqueo, la concentrazione di OH tende a scendere con l'altitudine man mano che l'aria diventa più fredda e secca.
|
 |
 |
 |
|
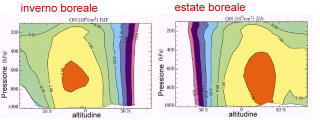
4. Distribuzione zonale di OH. Raggiunta l'altitudine di circa 11 km si ha una pressione atmosferica di 250 hPa (la tropopausa alla altitudine medie.) Fonte: presentazione di J. Lelieveld - MPI Mainz, 2003. Cliccare per allargare (80 K).
|
|
Le concentrazioni di radicale ossidrile non diminuiscono solo con l'altitudine ma anche con la latitudine poiché sia le concentrazioni di vapore acqueo e l'intensità della luce solare diminuiscono quando ci si muove verso i poli.
Come reagisce l'OH?
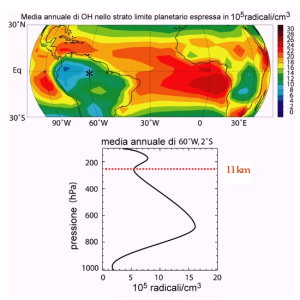
La figura sulla destra mostra come vicino al suolo sopra la foresta pluviale tropicale ci siano bassi livelli di OH. Perché ciò avviene? Le piante emettono gas organici di cui l'isoprene è il più abbondante. L'isoprene reagisce con OH rimuovendolo dall'aria e formando acqua e un radicale organico reattivo (R). OH ha una forte tendenza a rimuovere (in astratto) un atomo di idrogeno dalle specie organiche (RH) tutte le volte che questo è possibile. Il radicale organico (R) quindi reagisce con l'ossigeno (O2) per formare perossidi organici (RO2). Questi composti sono una parte essenziale del ciclo di formazione dell'ozono.
|
 |
 |
 |
|
5. La distribuzione di OH nei tropici. In alto: la distribuzione globale nelle regioni tropicali, sotto: analisi sopra stazione della foresta pluviale Manaus (Brasile). Fonte: presentazione J. Lelieveld MPI Mainz, 2003. Cliccare per allargare (80 K).
|
|
|
Su scala globale, OH reagisce primariamente con il monossido di carbonio (40%) per formare anidride carbonica. Circa il 30% di OH prodotto è rimosso dall'atmosfera per reazione con i composti organici e il 15% reagisce con il metano (CH4). Il rimanente 15% reagisce con l'ozono (O3), i radicali idro-perossi (HO2) e il gas idrogeno (H2).
|
 |
 |
|
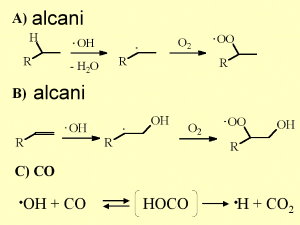
6. Importanti reazioni di OH nella troposfera. Cliccare per allargare (45 K).
|
|
 |
L'ossidazione del monossido di carbonio e del metano è molto importante in quanto consituisce il principale mezzo di rimozione OH dall'atmosfera. La reazione di OH con gli alcheni, una classe particolare di composti organici, è anch'essa molto importante in quanto questa reazione porta alla formazione di perossidi. OH può ossidare il monossido di carbonio CO e formare in questo modo l'anidride carbonica CO2. Come menzionato CO e metano sono i pozzi più importanti per OH. Altri composti organici sono solo presenti in tracce di un paio di ppt. Il CO invece raggiunge concentrazioni di circa 120 ppb nell'emisfero Nord (dove abbiamo più processi di combustione) e 60 ppb nell'emisfero Sud.
|
OH è il più importante ossidante nell'atmosfera. Tuttavia le concentrazioni di OH sono vicine allo zero di notte in quanto per la sua formazione è necessaria la luce solare. Perciò durante i periodi bui e di notte diventa importante, la chimica dell'ozono e del radicale di nitrato (NO3).
|
 |
 |
 |
|
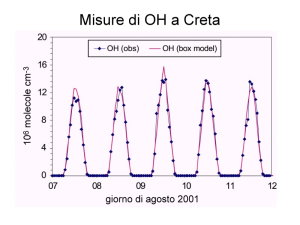
7. Analisi temporale delle concentrazioni di OH per alcuni giorni. Fonte: presentazione J. Lelieveld MPI Mainz, 2003. Cliccare per allargare.
|
|
* Il rapporto di mescolamento espresso in ppb (1 molecola in 1 miliardo di molecole dell'aria) o ppm (1 molecola in 1 milione di molecole di aria) è spesso utilizzato nelle pubblicazioni scientifiche così come in tutta la letteratura scientifica sull'atmosfera e il clima. Per questo motivo lo utilizziamo anche qui nell'Enciclopedia sul Clima. Tuttavia, la corretta unità di misura sarebbe 1 nmol mol-1 (equivalente a 1 ppb) o 1 µmol m-1 (per 1 ppm) poiché la mole è l'unità standard della concentrazione.
A proposito di questa pagina:
Versione italiana: Laura Dini (traduttore) e Michela Maione (revisione linguistica)
autore: Dr. Elmar Uherek - MPI for Chemistry, Mainz
revisione scientifica: Dr. Mark Lawrence - MPI for Chemistry, Mainz - 2004-05-05
revisione didattica: Michael Seesing - Uni Duisburg - 2003-07-02
rivisto e ultimo pubblicazione: 2004-05-07
|
|
 |
|







