|
|
 |
|
|
|
 |
| |
|
|
 |
Alta Atmósfera
Bases
|
Composición de la estratosfera
La mayoría de los compuestos emitidos en la superficie de la Tierra no alcanzan la estratosfera. Provienen de la descomposición por los principales oxidantes de la troposfera(OH, NO3 y ozono) por fotolisis, eliminados por deposiciones secas o húmedas o atrapados por la tropopausa. Debido a la inversión en la tendencia de la temperatura el intercambio de aire entre la troposfera y la estratosfera es lento. El intercambio vertical de la troposfera puede durar desde horas hasta días; y la mezcla de la estratosfera meses o incluso años.
|
|
|
|
|
 |
La primera consecuencia es que el contenido en vapor de agua de la estratosfera es muy bajo. Las proporciones de mezcla más típicas (la definición debajo) están entre 2 y 6 ppm (partes por millón) comparado con 1,000-40,000 ppm en la parte inferior de la troposfera y 100 ppm en la parte superior de la troposfera. Por ello la formación de nubes en la estratosfera es poco frecuente y requiere temperaturas muy bajas para que se formen los cristales de hielo. Tales condiciones se dan principalmente en las regiones polares, donde es posible que se formen las nubes de hielo estratosféricas. El contenido en vapor de agua de la estratosfera aumenta por ejemplo debido al tráfico aéreo, la temperatura decrece debido al calentamiento de la troposfera; por ello no se puede negar que la formación de nubes estratosféricas polares (NEP) es más probable.
|
 |
 |
 |
|
1. Nubes estratosféricas polares sobre Kiruna / Suecia
fuente: MPI Heidelberg - tamaño completo: 35 K
|
|
Los compuestos inorgánicos en la estratosfera
La química de la estratosfera está gobernada por el ozono. El 85-90% del total de ozono en la atmósfera se encuentra en la estratosfera. Este gas traza se forma por la fotolisis del oxígeno de la propia estratosfera. La fotolisis significa que la luz del sol rompe los enlaces de oxígeno de la molécula de O2. Muchos de los otros gases que entran en la estratosfera provienen de la troposfera debido a su larga vida (por ejemplo óxido nitroso N2O, metano CH4, clorofluorocarburos CFC, etc.) o han sido liberados en erupciones volcánicas (compuestos de sulfuro y aerosoles). Por esto los compuestos inorgánicos son los que predominan la composición de la estratosfera: óxidos de nitrógeno, ácido nítrico, ácido sulfúrico, ozono, halogenos y óxidos de halógenos por la destrucción de CFCs.
|
 |
 |
|
2. Erupción del Mt. Pinatubo Filipinas en Junio de 2001.
fuente: Cascades Volcano Observatory USGS Foto de Rick Hoblitt
|
|
 |
Erupciones volcánicas
Fuertes erupciones volcánicas pueden liberar grandes cantidades de gases y partículas directamente a la estratosfera. Estos gases son ácidos de halógenos como el HCl y el HF o dióxido de azufre SO2, que se oxida a ácido sulfúrico H2SO4 (que es uno de los componentes básicos para la formación de nubes). Las partículas (principalmente materiales inorgánicos como silicatos, halitas y sulfatos) pueden absorber luz ya en la estratosfera y por ello producir un calentamiento temporal de la estratosfera y enfriamiento de la troposfera. Estos efectos pueden durar uno o dos años y se pueden medir en cualquier punto del hemisferio después de las erupciones. Un ejemplo es Mt. Pinatubo que entró en erupción en Junio de 1991.
|
Concentraciones y ratios de mezcla
Podemos expresar la cantidad de un compuesto en la atmósfera de dos maneras, relativa y absoluta:
a) ratio de mezcla = la fracción de este compuesto en el total de moléculas de aire. Si hay 40 moléculas de ozono en un millón de moléculas de aire el ratio es 40 ppm (partes por millón). Esta es una medida relativa.
b) concentración = la masa de moléculas de este compuesto en un cierto volumen de aire. Si hay 100 µg de ozono en un metro cúbico de aire, la concentración es 100 µg / m3. Esta es una medida absoluta.
Con la ayuda de la presión de aire se puede pasar de medidas absolutas a relativas y viceversa.
La presión decrece con la altura, es decir, cuanto más arriba avanzamos en la estratosfera, menos moléculas hay por metro cúbico de aire. Esto significa que si la masa total de ozono permanece constante con la altura, la fracción relativa del total aumenta.
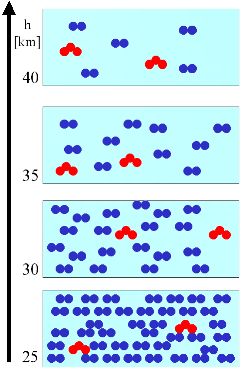
Explicamos este principio general con un sencillo ejemplo. En un volumen de aire (cuadro azul claro) hay un cierto número de moléculas de aire (azul) y un número de moléculas de ozono (rojo). El número de moléculas de aire decrece siempre con la altura.
|
 |
 |
|
3. (Ll) A la izquierda se asume que la cantidad de moléculas de ozono [concentración = moléculas/volumen = masa/volumen, unidad por ejemplo molec./m3, hPa, µg/m3] permanece constante con la altura (triángulos rojos del perfil). En relación a las moléculas de aire (círculos azules) el ratio [diamantes verdes, unidad por ejemplo %, ppm = µmol/mol, ppb = nmol/mol, ppt = pmol/mol] del ozono aumenta (ver debajo).
|
|
 |
 |
 |
|
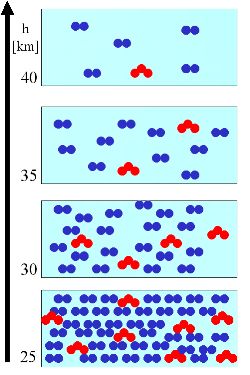
3. (Rl) A la derecha se asume que la cantidad de moléculas de ozono disminuye paralelamente a la cantidad de moléculas de aire. El ratio (moléculas de ozono por moléculas de aire) permanece constante con la altura (diamantes verdes): 8/40, 4/20, 2/10, 1/5 = 20%. Pero el número absoluto de moléculas de ozono por volumen de aire (triángulos rojos) disminuye.
|
|
 |
 |
|
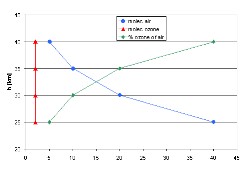
3. (L2) Un sencilo perfil de ozono para los ejemplos de arriba - la concentración (rojo) y el ratio (verde)
¡Pincha para ampliar!
|
|
 |
 |
 |
|
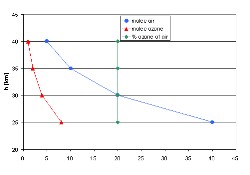
3. (R2) Un sencillo perfil de ozono para el ejemplo de arriba - la concentración (rojo) y el ratio (verde)
¡Pincha para ampliar!
|
|
|
¿Cuál es la realidad? El ejemplo de la derecha sólo es realista en lo más alto de la capa de ozono. El ejemplo de la izquierda es una buena descripción de lo que ocurre desde el suelo hasta la baja estratosfera. La concentración apenas varía, pero como el aire de alrededor se hace menos denso el ratio aumenta. En la baja estratosfera la concentración incluso aumenta (el ejemplo que aparece debajo aumenta ocho veces la concentración).
|
|
|
 |
En los libros puedes encontrar tanto el perfil rojo como el verde de ozono en la estratosfera. Pero no olvides que el ozono es 1 molécula entre un millón de moléculas de aire [1ppm].
4. Figura de la izquierda: perfil de ozono, se muestran tanto la concentración como el ratio
fuente: tomada de IUP Bremen
|
Sobre esta página:
autor: Dr. Elmar Uherek, MPI for Chemistry, Mainz
supervisor científico: Dr. John Crowley, MPI for Chemistry, Mainz - 04-05-2004
corrección pedagógica: Michael Seesing - Univ. of Duisburg, Dr. Ellen K. Henriksen - Univ. of Oslo, Yvonne Schleicher - Univ. of Erlangen-Nürnberg
última publicación: 05-05-2004
|
|
 |
|







