|
|
 |
|
|
|
 |
| |
|
|
 |
Los Océanos
Bases
|
Las propiedades del agua
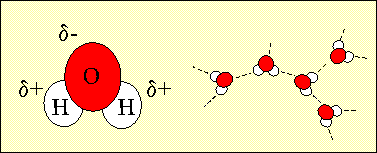
El 71% de la superficie terrestre está cubierta por agua y el 97% de este agua está en los océanos. La molécula de agua está compuesta por dos átomos de hidrógeno y uno de oxígeno. Debido a esta estructura del agua, el átomo de oxígeno tiene una ligera carga negativa y los átomos de hidrógeno una ligera carga positiva. Cuando las moléculas de agua están cerca unas de otras, las zonas de distinta carga se atraen entre sí, estas fuerzas de atracción se conocen como puentes de Hidrógeno y son los responsables de las características tan especiales que tiene el agua y que han hecho posible la vida sobre la Tierra.
|
 |
 |
|
1. Esta es la estructura del agua donde se puede ver la peqeña carga negativa sobre el oxígeno y la acrga positiva sobre los átomos de hidrógeno. La naturaleza polar de la molécula de agua le permite formar puentes de hidrógeno con otras moléculas de agua. Autor: Lucinda Spokes.
|
|
|
|
|
 |
- El agua es la única sustancia que podemos encontrar en la Tierra de forma natural como gas (vapor de agua), líquido o sólido (hielo)
|
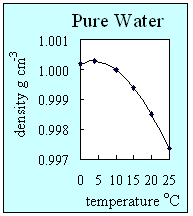
- La densidad es la medida que nos dice cómo de compacta es una sustancia. Se define como la unidad de masa dividida po el volumen que ocupa. Normalmente los sólidos suelen ser la forma más densa de cualquier sustancia, después los líquidos y después los gases. Normalmente la densidad disminuye con el aumento de temperatuura. Sin embargo el agua pura es una excepción a todo esto ya que alcanza su mayor densidad cuando se encuentra a 4ºC. Cuando el agua se convierte en hielo los puentes de hidrógeno le dan una estructura perecta y ordenada que hace que sea menos denso que el agua líquida a bajas temperaturas y por eso el hielo flota sobre el agua.
|
 |
 |
 |
|
2. ¿Cómo cambia la densidad del agua con la temperatura? Este gráfico muestra que el agua alcanza su mayor densidad a los 4ºC cuando todavía es un líquido. Autor: Lucinda Spokes.
|
|
 |
 |
|
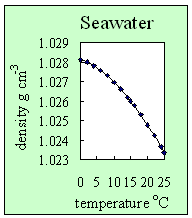
3. ¿Cómo cambia la densidad del agua salada con la temperatura? Con una concentración de sal determinada (en este caso el 35%), la densidad del agua salada desciende con la temperatura. Autor: Lucinda Spokes.
|
|
 |
- Añadir sal al agua aumenta su densidad e impide la formación de puentes de hidrógeno. Esto se traduce en que, al contrario que el agua pura, el agua salada no tiene su máxima densidad a 4ºC sino cuando se congela y también se traduce en que el agua salada se congela a temperaturas por debajo de 0ºC (por eso se pone sal en las carreteras en invierno, para que el hielo tarde más en formarse)
|
- El agua tiene un calor específico muy alto, lo que significa que se necesita mucha energía para aumentar su temperatura (se necesita energía para romper los puentes de hidrógeno). Como la superficie de la Tierra está cubierta en un 71% por agua la energía que viene del Sol sólo produce cambios muy pequeños en l atemperatura del planeta. El agua evita que la temperatura sea demasiado alta o demasiado baja y permite que pueda haber vida sobre la Tierra. El calor se almacena en el agua durante el verano y se libera durante el invierno. Los océanos actúan como moderadores del clima reduciendo las diferencias de temperatura durante las estaciones.
|
 |
 |
 |
|
4. Hace falta 4 veces más de energía para aumentar la temperatura del agua el 1ºC que para el aire. Autor: Lucinda Spokes.
|
|
- El agua también tiene un alto calor latente de evaporación, esto significa que hace falta mucha energía para evaporar el agua líquida. A medida que el vapor de agua se mueve de las zonas más cálidas a otras más templadas el vapor se condensa de nuevo formando lluvia. Este proceso libera energía y calienta el aire ligeramente. A nivel global hay una gran cantiadd de energía involucrada en estos procesos dando lugar a importantes tormentas y vientos.
- Muchas sustancias se disuelven en agua fácilmente y son estabilizadas por los puentes de hidrógeno, así se permite el transporte de oxígeno, de dióxido de carbono, nutrientes y se hacen posibles los procesos biológicos.
- Las moléculas de aceite no tienen carga eléctrica y por lo tanto no pueden romperse en moléculas más pequeñas y estabilizarse en el agua. El aceite no es soluble en el agua.
|
 |
 |
|
5. Olas rompiendo sobre un barco de investigación, porWendy Broadgate. Otras imágenes de NOAA.
|
|
Sobre esta página:
autor: Lucinda Spokes - Environmental Sciences, University of East Anglia, Norwich - U.K.
1. Revisión científica:
2. Revisión científica:
Revisión educativa:
última actualización: 2003-12-10
|
|
 |
|







