|
|
 |
|
|
|
 |
| |
|
|
 |
El clima en las ciudades
Bases |
¿Qué es la lluvia ácida?
El agua es esencial para la vida en la tierra. Por tanto, cuando está contaminada, afecta a todo el medio ambiente. La lluvia ácida es debida principalmente a las emisiones antropogénicas de contaminación atmosférica, provocadas por la quema de combustibles sólidos. La acidez de la lluvia se puede medir con la escala de pH. |
|
|
|
|
 |
|
Las precipitaciones atmosféricas (lluvia, llovizna, nieve, etc.) llegan a los ríos, y se infiltran en el suelo o se evaporan formando vapor de agua. Un parámetro importante para describir la calidad del agua es el pH.
|
 |
 |
|
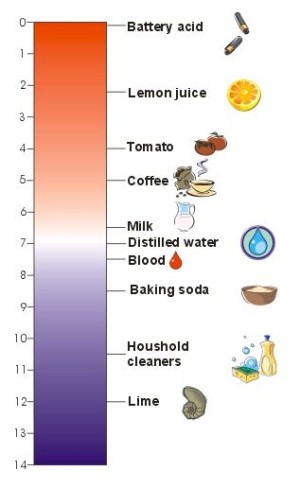
1. La escala del pH. El pH típico de algunos alimentos y soluciones acuosas concentradas que usamos en casa. Cuanto más bajo sea el número, mayor es su acidez.
Autor: Sebastian Wypych
|
|
 |
La escala de pH
En la naturaleza, encontramos muchos compuestos químicos que se disuelven en agua, formando soluciones acuosas con un determinado pH. Cuanto más ácida es la solución, más bajo es su pH. El pH es el logaritmo negativo de la concentración del ión hidronio en moles por litro (mol/l).
pH = -log10[H+]
Si la concentración del ión hidronio es c(H+) = 10-7mol/l, el pH es 7, si es 10-6 mol/l, el pH es 6, etc.
Esta escala la inventó el científico danés Soren Sorenson en 1909. La escala del pH varía de o a 14, con un valor de 7 considerado como neutro. Los valores por encima de 7 son alcalinos y por debajo de 7 son ácidos. Por ejemplo, el vinagre tiene un pH 2.5-3, agua destilada 7.0, solución acuosa concentrada de bicarbonato sódico (NaHCO3(aq)) 8.2, algunos productos de limpieza con hidróxido de amonio (NH4OH(aq)) 11-12, y la cal apagada (Ca(OH)2(aq)) 12.4.
En agua pura, la única fuente de H+ es la siguiente reacción:
H2O -><- H+ + OH-
agua ión ión
líquida hidrógeno hidróxido
Las flechas en dos direcciones indican que la reacción es reversible. Los ácidos son sustancias que cuando se añaden a una solución, se disocian aumentando la molaridad de H+. Cuanto más H+ se añada, más fuerte será el ácido, y menor será su pH. |
|
Lluvia ácida
Las precimitaciones suelen ser algo ácidas, ya que el dióxido de carbono (CO2) que aparece de forma natural en el aire se disuelve, creando una solución de ácido carbónico (H2CO3) y causa un pH alrededor de 5.6. Esto es debido a que el ácido carbónico no es estable y se disocia en agua formando iones hidronio y carbonato de hidrógeno:
|
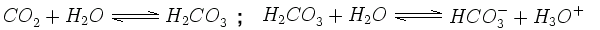 |
 |
|
En una solución más alcalina de pH mayor, el carbonato de hidrógeno puede perder otro ion hidrógeno y convertirse en carbonato. Muchas rocas y sedimentos, por ejemplo, dolomita o caliza, están formados por sales carbonadas.
|
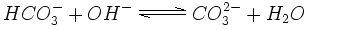 |
 |
|
|
|
Pero la lluvia limpia es ligeramente ácida por la disociación del ácido carbónico. Hablamos de lluvia ácida cuando el pH de las precipitaciones es menor que 5.6. Sin embargo, algunos científicos consideran lluvia ácida las precipitaciones con pH<5.0. Aparte de la lluvia ácida puede haber también nieve o niebla ácida, por lo que podemos hablar de forma general de precipitaciones ácidas. La contribución del hombre a la formación de lluvia ácida viene de los compuestos de nitrógeno y azufre.
SO2 y NOx pasan por una serie de etapas en complejas reacciones químicas antes de convertirse en el ácido sulfúrico (H2SO4) o el ácido nítrico (HNO3) que se encuentran en la lluvia ácida.
|
 |
El ácido sulfúrico procede de compuestos sulfurosos:
el dióxido de azugre y oxígeno reaccionan dando trióxido de azufre:
2SO2 +O2 -> 2SO3
el trióxido de azufre y el agua reaccionan dando ácido sulfúrico:
SO3 + H2O -> H2SO4
El ácido nítrico proviene de óxidos de nitrógeno:
el dióxido de nitrógeno y el agua reaccióna dando ácido nítrico y ácido nitroso:
2NO2 + H2O -> HNO3 + HNO2 |
|
El pH de una nube ácida puede ser menor de 2.6. El pH de la lluvia ácida en regiones altamente industrializadas suele ser alrededor de 4.0; las nieblas que se producen en Los Ángeles suelen tener un pH menor de 3.0. Sin embargo, en algunas zonas del mundo, como el norte de Australia, las emisiones orgánicas de vegetación natural producen un pH alrededor de 4.4.
|
Causas: Emisiones de SO2 y NOx
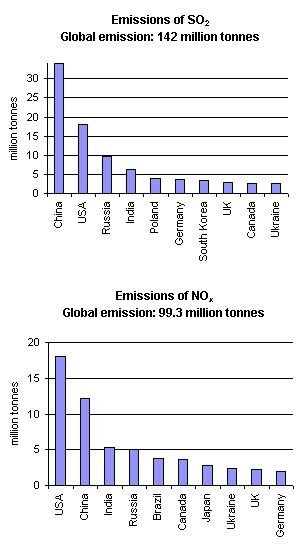
¿Qué origina la lluvia ácida? Los ácidos atmosféricos se producen en el aire principalmente, como resultado de las reacciones químicas de los gases ácidos precursores (SO2 y NOx) y agua. La mayor parte de SO2 y NOx se emite a la atmósfera por la quema de combustible fósil. El transporte en carreteras, en barco y en avión son fuentes significativas de emisión de NOx; las fuentes naturales incluyen los volcanes, la caída de rayos y la descomposición biológica. Las fuentes naturales de SO2 son volcanes, océanos (sulfuro de dimetilo y COS), descomposición biológica e incendios forestales. La lluvia ácida, sin embargo, es principalmente un efecto de las emisiones causadas por el hombre. La Figura 2 presenta los 10 países que emiten más SO2 y NO2. En ambos casos, EEUU, China, Rusia e India emiten las mayores cantidades, debido principalmente al gran número de habitantes, sin embargo, en EEUU por ejemplo, las emisiones per cápita son también muy elevadas debido a la gran cantidad de energía usada.
|
 |
 |
 |
|
2. Emisiones de SO2 y NOx en 1995
Autor: Anita Bokwa
Fuente de datos: World Resources Institute, Washington DC
http://earthtrends.wri.org
|
|
Incertidumbres en las emisiones globales
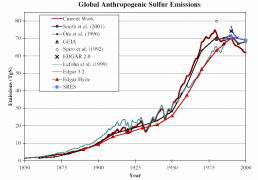
Existen grandes incertidumbres a la hora de recopilar los inventarios de las emisiones globales de SO2 y NOx. Se estima que las emisiones naturales de SO2 alcanzan del 25 al 50% del total de las emisiones globales. Sin embargo, en regiones industrializadas y urbanizadas, se cree que las fuentes antropogénicas liberan el 90% de SO2 y NOx. Las incertidumbres varían fuertemente de una región a otra. Están asociadas a la escasez de datos, especialmente en agricultura y a las medidas de flujo para fuentes difusas como el suelo y los sistemas acuáticos. La Figura 3 presenta los resultados de varios estudios. Observa que en la figuras 3 y 4, los valores se refieren a azufre puro, mientras que la figura 2 a dióxido de azufre.
|
 |
 |
 |
|
3. Desarrollo de las emisones globales de azufre antropogénico. Se presentan y comparan varios estudios en un diagrama.
Fuente: S. J. Smith, R. Andres, E. Conception, J. Lurz, 2004, Sulfur dioxide emissions: 1850-2000 (JGCRI Report. PNNL-14537)
Pincha aquí para verlo más grande (26 K)!
|
|
|
Cambios en las emisiones
Los humanos han duplicado el valor natural de fijación de nitrógeno (N), y los índices de acumulación de N atmosférico han aumentado de 3 a 10 veces, comparado con la época preindustrial. La emisión de azufre (S) a la atmósfera también ha aumentado más del doble.
|
 |
 |
|
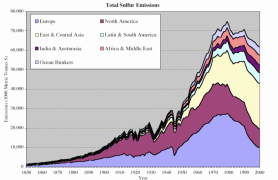
4. Contribución de las regiones del mundo más desarrolladas económicamente a las emisiones antropogénicas de azufre desde 1850.
Fuente: S. J. Smith, R. Andres, E. Conception, J. Lurz, 2004, Emisiones de dióxido de azufre: 1850-2000 (JGCRI Report. PNNL-14537)
Explicaciones: Austurasia - Australia, New Zealand, South-Eastern Asia, Ocean Bunkers - Combustibles fósiles empleados para el transporte oceánico
Pincha para ver la imagen más grande (66 K)!
|
|
 |
Desde la revolución industrial, Europa y Norteamérica dominaban la aportación humana a las emisiones globales de azufre. Sin embargo, las emisiones crecientes del este y centro de Asia fueron los principales responsables del aumento global de emisiones en los 70. Las emisiones de dióxido de azufre en Europa ya mostraban un notable aumento al final del siglo XIX, debido a la industrialización y al incremento del consumo de carbón. A partir de 1945 el consumo de petróleo creció muy rápido; las emisiones de azufre se duplicaron entre el final de la guerra y principio de los 70. |
|
Hoy en día, las dimensiones del problema de la lluvia ácida están creciendo de forma rápida en Asia, con emisiones de SO2 que se espera que tripliquen los niveles desde 1990 a 2010 si continuan las tendencias actuales. Reducir los daños sustanciales que provoca la lluvia ácida en Asia y evitar daños mucho mayores en el futuro requrerirá unas inversiones en el control de la contaminación como las que se hicieron en Europa y Norteamérica hace más de 20 años. Por ejemplo, las emisiones de dióxido de azufre en Europa se han reducido en un 44% en el periodo de 1990 a 1998. Las emisiones de óxidos de nitrógeno cayeron un 21% en ese mismo periodo. EEUU y Canadá experimentaron una disminución del 28% en emisiones de SO2 entre 1980 y 1995.
|
|
Las emisiones están concentradas en determinadas regiones del mundo. En Asia Occidental es donde se producen mayores emisiones de SO2 , mientras que EEUU libera las mayores cantidades de NOx.
|
Sobre esta página:
autores: Anita Bokwa - Jagiellonian University, Cracow, Poland and Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz, Alemania
corrección pedagógica: Michael Seesing - University of Duisburg, Duisburg, Alemania
última actualización: 17-08-2004
|
|
 |
|







