|
|
 |
|
|
|
 |
 |
|
|
 |
Principi fondamentali B2: polarità e ioni
 Legami salini Legami salini
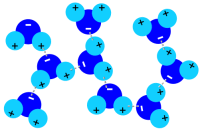
L’acqua tende a stare più facilmente allo stato liquido o solido poiché le sue particelle si attraggono reciprocamente. Per questo motivo, le molecole dell’acqua si definiscono polari e si comportano come piccoli magneti caratterizzati dall’attrazione reciproca. |
I sali, ancor più dell’acqua, si trovano facilmente allo stato solido. Le particelle più piccole che li compongono, gli ioni positivi e negativi, esercitano tra loro una potente forza di attrazione.
Chiedete in prestito ai vostri genitori una vecchia pentola ormai inutilizzata. Mettetela sul fornello e versatevi un cucchiaino di sale da tavola. Accendete il fornello portando la fiamma al massimo. Che cosa accade?
|
 |
 |
 |
|
1. Legami polari a idrogeno nell’acqua allo stato liquido; immagine: Elmar Uherek
|
|
|
Come avrete avuto modo di osservare, la potente fonte di calore non influisce sullo stato del sale. I sali sono idrosolubili ma in un ambiente asciutto danno origine a cristalli stabili. Questo fenomeno si verifica poiché le particelle più piccole, gli ioni, tendono ad attrarsi vicendevolmente con forte intensità.
|
 |
 |
|
4. Solfato di ammonio osservato a forte ingrandimento Fonte: PSI
|
|
 |
 I sali presenti nell’aria I sali presenti nell’aria
Gli ioni presenti in un cristallo salino sono pertanto caratterizzati da forti cariche positive e negative difficilmente separabili le une dalle altre e la loro forza di attrazione è simile a quella esercitata da potentissimi magneti. Una volta che i sali vengono immessi o si formano nell’aria per reazione chimica, questi non subiranno più il processo di evaporazione. |
|
I sali formano particelle saline sospese che possono attrarre l’umidità dell’aria. Se le dimensioni aumentano, le particelle tendono a ricadere al suolo. Per produrre particelle estremamente fini, si utilizza una reazione chimica che rappresenta anche un’importante fonte di produzione naturale di particelle: si fanno reagire l’acido solforico e l’ammoniaca, che formano i sali di solfato di ammonio.
|
|
 |
|







