|
|
 |
|
|
|
 |
| |
|
|
 |
Alta Atmósfera
Saber más
|
La química del ozono estratosférico
Fue fundamentalmente después de 1980 cuando nuestro conocimiento sobre la química del ozono estratosférico creció mucho. La razón fue el descubrimiento del agujero de la capa de ozono en 1985. Las dos secciones siguientes dan una visión global de la química de la estratosfera en su marco histórico.
|
|
|
|
|
 |
Descubrimiento del ozono y primeras medidas
La investigación del ozono es una rama bastante antigua de la ciencia atmosférica. En 1840 el gas fue bautizado como "ozono" (el olor) por el químico Christian Friedrich Schönbein, quien descubrió que esta sustancia se formaba durante descargas eléctricas. Muy pronto se descubrió que el ozono era un componente natural del aire. El primer método de medida de este gas lo desarrolló el propio Schönbein, pero muy pronto fue mejorado en el Observatorio Mt. Souris de Paris. De ahí vienen las primeras series de datos (1876 - 1910) que hoy son la mejor aproximación de las concentraciones preindustriales de la capa fronteriza.
|
 |
 |
 |
|
1. Christian Friedrich Schönbein
fuente: Página Web de la Swiss Academy of Science techniques
|
|
 |
 |
|
2. El espectrómetro Dobson
Cortesía de: Ulf Köhler, DWD Hohenpeissenberg
¡Pincha aquí para ampliar! (130 K)
|
|
 |
En 1879 se descubrió que la región UVB del espectro solar disminuye significativamente en la superficie de la Tierra y en 1880 se supo que el ozono es un fuerte absorbente en este rango, y por ello podría ser el responsable. Sin embargo, la cantidad de ozono disponible en la baja troposfera no puede explicar esta disminución. Por ello se ha asumido que la mayor parte del ozono tiene que formarse en capas altas de la atmósfera. La investigación clave fue llevada a cabo por Gordon Dobson en los años 20 del siglo XX. Desarrolló el espectrómetro Dobson que se ha utilizado desde 1929 para medir la columna de ozono total, y está siendo actualmente reemplazado de manera gradual por métodos modernos, pero todavía se usa.
Para más detalles sobre como funciona un espectrómetro Dobson pincha  ¡AQUÍ! ¡AQUÍ!
|
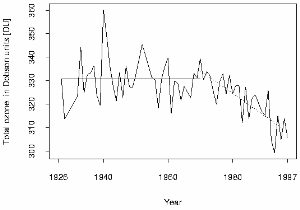
Uno de los seis primeros espectrómetros Dobson lo usó Paul Götz en Arosa (Suiza) y desde entonces se han hecho las mayores series de medidas de la columna de ozono total en el mundo. La tendencia muestra que también sobre Europa la capa se hizo más fina. En los últimos años se han medido en verano en Hohenpeissenberg valores por debajo de 300 DU, un límite crítico que hace necesaria una mejor protección solar. También los 200 DU en primavera durante la época del agujero de la capa de ozono sobre el hemisferio norte (marzo) son muy peligrosos.
En los años treinta del siglo XX Götz demostró que el máximo de la concentración de ozono está muy probablemente por debajo de los 25 km. La capa de ozono estaba más o menos medida, así como su grosor.
|
 |
 |
 |
|
3. Las series de ozono Arosa
fuente: ETH Zürich
|
|
 |
 |
|
4. Las reacciones de Chapman
Esquema por EU
¡Pincha para ampliar! (40 K)
|
|
 |
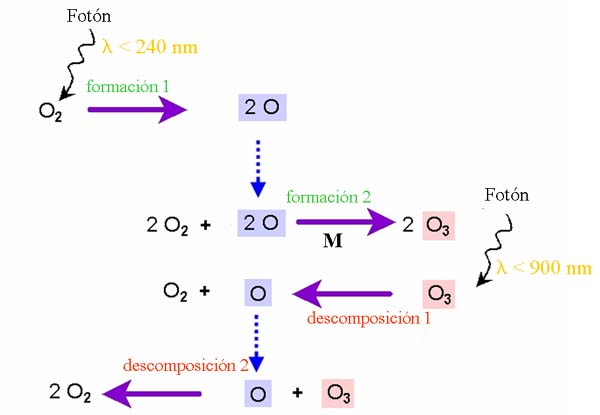
Las reacciones de Chapman
¿Pero cómo se forma y se elimina el ozono continuamente? También el 1929 y 1930 S. Chapman publicó la teoría de la formación y destrucción del ozono. Las reacciones son aún válidas y se conocen con el nombre de " Ciclo de Chapman" o "reacciones de Chapman".
El oxígeno y el ozono se transforman de uno a otro. Los enlaces se rompen por fotolisis debido a la radiación solar. Para romper el enlace del O2 la energía solar debe ser más fuerte ( longitud de onda menor de 240 nm) que para los de ozono ( longitud de onda menor de 900 nm). La formación y la destrucción están en equilibrio y el resultado final es una reacción "cero":
3 O2 -> 2 O3 y 2 O3 -> 3 O2
|
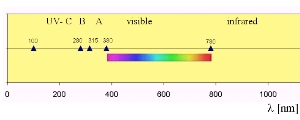
Absorción en el UV
Dependiendo de la absorción de una molécula, un enlace puede ser roto por la radiación pura. Cada molécula absorbe energía en un rango determinado del espectro electromagnético. El oxígeno absorbe en el rango de alta energía del UV-C, el ozono en el rango UV-B, que es un poco menos energético. Longitudes de onda más larga atraviesan la atmósfera parcialmente y llegan a la superficie de la Tierra.
5. Espectro de absorción ( a la derecha):
La imagen muestra el espectro de absorción combinada de los principales absorbentes de radiación solar en la alta atmósfera. Indica la altitud a las que las respectivas partes de la radiación llegan. La luz de entre 200 y 300 nm se bloquea ya en la ionosfera y mesosfera por el nitrógeno N2, átomos de O y oxígeno O2. La luz de entre 200 y 320 nm llega más abajo en la estratosfera ( por debajo de 50 km), donde es absorbida principalmente por el ozono O3. Finalmente la radiación de más de 320 nm alcanza la superficie de la Tierra.
|
 |
|
|
Sin embargo, una pequeña fracción de la radiación UV-B alcanza la superficie de la Tierra, permitiendo la formación de radicales OH que limpian la troposfera. Esta fracción es crítica también para las consecuencias biológicas como las quemaduras del sol y el daño del ADN.
|
La reducción del ozono por parte de los radicales
Poco a poco se fue demostrando que las concentraciones medidas de ozono no podían explicarse simplemente con las sencillas reacciones de Chapman. Desde 1970 Crutzen, Molina, Rowland (Premio Nobel de 1995) y otros científicos han desarrollado la teoría de una implicación de los óxidos de nitrógeno y de los radicales halógenos en la química del ozono. Molina y Rowland ya habían descubierto en 1974 que los clorofluorocarbonos destruyen el ozono.
|
 |
 |
 |
|
6. Radiación UV en el espectro electromagnético
Además de la que se da aquí, existen otras definiciones de los rangos de radiación; por ejemplo el IPCC define la radiación UV-A entre 315-400 nm.
compuesto por: Elmar Uherek
¡Pincha para ampliar! (60 K)
|
|
 |
 |
|
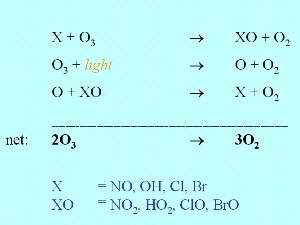
7. Reducción química del ozono
¡Pincha para ampliar! (40 K)
|
|
 |
El ozono no se rompe únicamente por fotolisis, sino que también debido a la reacción con un compuesto X , que puede ser óxido nitroso NO, el radical hidroxilo , que puede ser óxido nitroso NO, el radical hidroxilo  OH, o un radical de halógeno como Cl OH, o un radical de halógeno como Cl o Br o Br . Otros radicales de menor importancia también pueden reaccionar de esta manera. . Otros radicales de menor importancia también pueden reaccionar de esta manera.
Desde que se conoció que las actividades humanas liberan compuestos que contienen halógenos, los científicos pronosticaron un ligero descenso de la concentración de ozono. Sin embargo, la idea de los procesos estratosféricos no era aún conocida totalmente, y hasta que en 1985 se detectó el agujero de la capa de ozono sobre la Antártida, nunca se había esperado una disminución tan drástica de ozono como la sufrida por éste.
|
Sobre esta página:
autor: Dr. Elmar Uherek - MPI for Chemistry, Mainz
supervisor científico: Dr. Christoph Brühl - MPI for Chemistry, Mainz
corrección pedagógica: Michael Seesing - Uni Duisburg - 07-08-2003
última publicación: 11-05-2004
|
|
 |
|







