|
|
 |
|
|
|
 |
| |
|
|
 |
Alta Atmósfera
Saber más
|
Química del cloro
Fundamentalmente, la química de cloro está llevando a la destrucción de la capa de ozono. Con la producción industrial de clorofluorocarbonos (CFCs), el hombre introdujo una nueva fuente de cloro en la atmósfera. Ahora, el nivel de cloro es seis veces mayor de lo que era debido a sus fuentes naturales, con unas consecuencias fatales para la capa de ozono. Sin embargo, las condiciones para la formación del agujero de la capa son muy especiales. Por ello, no se había previsto un desarrollo tan drástico.
|
|
|
|
|
 |
 |
 |
|
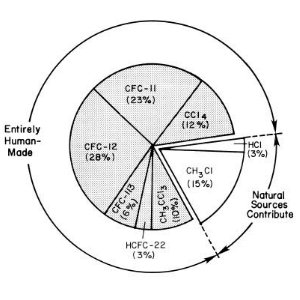
1. Fuentes Fundamentales de Cloro Entrando en la Estratosfera a Principios de 1990
fuente: UNEP/WMO Scientific Assessment of Ozone Depletion
|
|
 |
CFCs- gases de fuentes no naturales
Los gases destructores de ozono con mayor potencial para influir en el clima son CFC-11 (CFCl3), CFC-12 ( CF2Cl2) y CFC-13 (CF2ClCFCl2). Actualmente está claro, debido a las medidas tomadas en el aire polar, que hay fuentes no naturales que liberan estos compuestos. La única fuente natural de cloro significativa es el clorometilo CH3Cl, que es un compuesto con una vida relativamente corta de 1.3 años.
Debido a su estabilidad frente al radical OH y a la fotolisis en la troposfera, los CFCs tienen una vida estratosférica muy larga, de entre 50 a 100 años. Alcanzan la estratosfera y son fotolizados, lo que lleva a la formación de radicales de cloro. El hecho de que estos radicales estén disponibles no significa necesariamente una merma del ozono, puesto que compiten con otras reacciones. Tal y como se explicará en las siguientes páginas, se requieren unas condiciones especiales.
|
Las condiciones especiales del agujero de la capa de ozono de la Antártida
Durante la noche polar con temperaturas de alrededor de -80°C, la pequeñísima cantidad de agua disponible en la estratosfera es capaz de congelarse y de formar nubes estratosféricas, junto con ácido nítrico (el llamado ácido nítrico trihidratado ANT, o NAT). Ahora las cinco condiciones clave vienen de la mano:
|
 |
 |
|
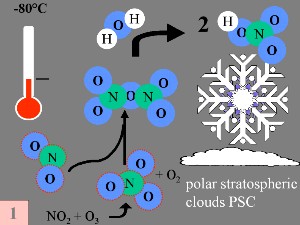
3. a-d) Las condiciones especiales y la química de la formación del agujero de la capa de ozono.
Imágenes por: Elmar Uherek; Tamaño completo: 50-100 KB
|
|
 |
Primera: Los catalizadores del óxido de nitrógeno( óxido de nitrógeno NO y dióxido de nitrógenoNO2), que ayudan a convertir el ClO en HCl como se muestra arriba, son eliminados de la fase gaseosa de la estratosfera a través de las reacciones en HCl como se muestra arriba, son eliminados de la fase gaseosa de la estratosfera a través de las reacciones
 NO + O3 -> NO + O3 ->  NO2 + O2 NO2 + O2
 NO2 + NO2 +  NO3 + M* -> N2O5 + M NO3 + M* -> N2O5 + M
N2O5 + H2O -> 2 HNO3
produciendo por lo tanto ácido nítrico HNO3 que es incorporado a las partículas de las nubes estratosféricas polares (NEP o PSC).
|
|
|
 |
Segunda: En la superficie de las nubes estratosféricas polares (NEP o PSC) las partículas de hielo de las "especies de reserva" de cloro no reactivo, HCl y ClONO2, reaccionan entre sí para producir Cl2 y HNO3; éste último es inmediatamente incorporado a las partículas.
Tercera: Cuando vuelve a hacerse de día al final de la noche polar, el Cl2 es fotolizado y produce dos radicales de Cl. El cloro se ha reactivado.
|
|
|
 |
Quinta: Las especies de cloro más habituales como el Cl , ClO , ClO y el Cl2O2 se forman y se concentran más en la alta estratosfera y el ozono en baja estratosfera. Por ello hace alguas décadas los expertos no pronosticaron una disminución significativa del ozono. El ozono y sus destructores sólo deberían estar juntos en las zonas fronterizas. En este punto entra en juego el vortex polar: las especies de cloro son llevadas por advección a la baja estratosfera mediante el transporte del viento desde la alta y media estratosfera dentro de este vortex polar meteorológicamente estable ( viento circumpolar), con el polo situado aproximadamente en el centro. Así es como las especies de cloro destructoras de oxígeno son transportadas a latitudes más bajas, donde se acumula la mayor parte del oxígeno. y el Cl2O2 se forman y se concentran más en la alta estratosfera y el ozono en baja estratosfera. Por ello hace alguas décadas los expertos no pronosticaron una disminución significativa del ozono. El ozono y sus destructores sólo deberían estar juntos en las zonas fronterizas. En este punto entra en juego el vortex polar: las especies de cloro son llevadas por advección a la baja estratosfera mediante el transporte del viento desde la alta y media estratosfera dentro de este vortex polar meteorológicamente estable ( viento circumpolar), con el polo situado aproximadamente en el centro. Así es como las especies de cloro destructoras de oxígeno son transportadas a latitudes más bajas, donde se acumula la mayor parte del oxígeno.
|
Las cinco condiciones deben darse a la vez para formar el agujero de la capa de ozono. Por esta razón la mayor destrucción de ozono tiene lugar sobre la Antártida y únicamente durante los meses de septiembre / octubre (primavera antártica), en los que el sol sale después de la noche polar. En pocos años, tenemos unas condiciones comparables en el Ártico en Marzo, y también un pequeño agujero se va formando en el Norte de Europa. Al final del año, las nubes polares se disuelven, los óxidos de nitrógeno vuelven a estar disponibles, el vortex polar se quebranta y los radicales de cloro son eliminados; por lo que la capa de ozono se recupera.
|
 |
 |
 |
|
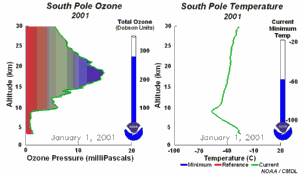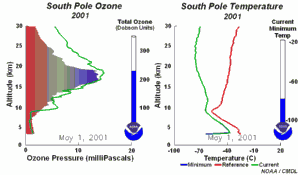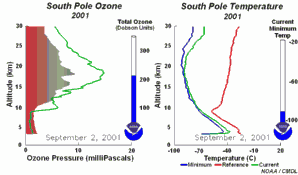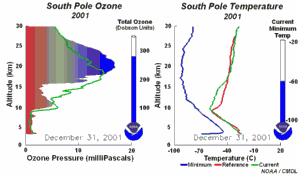
4. Desarrollo del agujero de la capa de ozono 2001
¡Pincha para ampliar una secuencia de 5 días (270K)!
Animación original proporcionada por el NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado.
|
|
M*: En cualquier tipo de reacción A + B -> C es necesario un tercer compañero, que elimina la energía en exceso. De otro modo el producto C podría tener la misma energía que la suma de los reactivos A + B y directamente se produciría la reacción inversa. En la mayoría de los casos M es el nitrógeno del aire N2.
|
Sobre esta página:
autor: Dr. Elmar Uherek - MPI for Chemistry, Mainz
supervisor científico: Dr. Christoph Brühl, MPI for Chemistry, Mainz
corrector pedagógico: Michael Seesing - Uni Duisburg - 07-08-2003
última publicación: 11-05-2004
|
|
 |
|







