|
|
 |
|
|
|
 |
| |
|
|
 |
Baja Atmósfera
Bases |
Óxidos de nitrógeno - Formación e Importancia
Los óxidos de nitrógeno juegan un importante papel en los procesos atmosféricos. ¿Cómo se forman?¿Por qué son importantes?
|
1. Trafico - una fuente importante de óxidos de nitrógeno.
(c) FreeFoto.com |
|
|
|
|
 |
¿De dónde vienen los óxidos de nitrógeno?
Los óxidos de nitrógeno más importantes son el monóxido de nitrógeno NO y el dióxido de nitrógeno NO2. Los dos juntos se llaman NOx. Las moléculas de nitrógeno (N2) en el aire son muy estables y difícilmente oxidables. Algunas bacterias han desarrollado mecanismos especiales para romper el triple enlace N-N y formar compuestos oxidados. Pero hay procesos de mayor relevancia en los que este enlace se rompe por calor. Ésto solo ocurre bajo condiciones extremas, como por ejemplo en la combustión de gasolina en el motor de un coche. La mayoría del NOx producido por los humanos proviene de esta fuente. Pero ésto también puede ocurrir en otras reacciones muy caloríficas como en la parte más caliente de las llamas que se producen al arder la biomasa. Pero sin duda alguna la mayor fuente son las tormentas eléctricas, concretamente los rayos, donde se alcanzan temperaturas de 30,000 ºC y los enlaces del nitrógeno se rompen con gran facilidad.
2. derecha: Los rayos son una importante fuente de nitrógeno.
foto por Bernhard Mühr  Karlsruher Wolkenatlas Karlsruher Wolkenatlas
|
 |
|
 |
 |
|
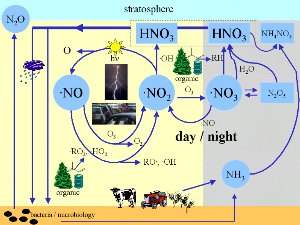
3. ¿Dónde están implicados los óxidos de nitrógeno en los process atmosféricos? El esquema da una pequeña visión (no completa) de los procesos importantes en la química atmosférica.
¡Pincha el esquema para ampliar! (100 K)
por Elmar Uherek para ESPERE
|
|
 |
¿En qué procesos están implicados?
Encontramos los NOx (= NO + NO2) y otros óxidos de nitrógeno prácticamente en todas partes en la química atmosférica. Durante la noche, se forman los radicales nitrato NO3 y son los oxidantes más activos. Los radicales son especies químicas muy inestables y que normalmente reaccionan extremadamente rápido.
Si el N2O5 se forma en zonas de polución, éste puede reaccionar en las gotitas o en superficies húmedas con el agua y formar HNO3. El HNO3 contribuye al carácter ácido de la lluvia. El ácido nítrico, que también puede formarse durante el día por oxidación del NO2, es el principal modo por el que los óxidos de nitrógeno son eliminados de la atmósfera, ya sea por sedimentación seca o húmeda (lavado por la lluvia).
El ácido nítrico forma además parte de las nubes estratosféricas polares. El ácido nítrico trihidrato forma las partículas por las que se desarrolla el agujero de la capa de ozono (detalles en "Alta Atmósfera (estratosfera) - Más - Unidad2).
|
|
Nombres de los compuestos de nitrógeno:
|
Fórmula |
Nombre sistemático |
Nombre común |
|
NO |
monóxido de nitrógeno |
óxido nítrico |
|
N2O |
monóxido de dinitrógeno |
óxido nitroso |
|
NO2 |
dióxido de nitrógeno |
peróxido de nitrógeno |
|
N2O5 |
pentaóxido de dinitrógeno |
anhídrido nítrico |
|
N2O3 |
trióxido de dinitrógeno |
anhídrido nitroso |
|
HNO3 |
- |
ácido nítrico |
|
NH3 |
- |
amoniaco |
|
|
Los óxidos de nitrógeno gaseosos son muy importantes en la formación y descomposición del ozono troposférico, ya que están implicados en procesos catalíticos. Ésto ocurre principalmente, porque el NO2 puede romperse por fotolisis por la luz del sol. Ésto produce NO, el cual se oxida de nuevo a NO2. El ozono, al igual que los radicales peróxidos (compuestos oxidados inestables), puede estar implicado en estos procesos como veremos con detalle en el siguiente texto.
La principal razón para que se inventaran los catalizadores de los coches fue evitar la emisión de óxidos de nitrógeno. Nosotros emitimos demasiados en los procesos de combustion, especialmente en los coches, y perturbamos el equilibrio del aire. El óxido nitroso NO2, por ejemplo, lo forman las bacterias en los procesos de degradación. La microbiología de unos organismos vivos tan pequeños juega un gran papel en el ciclo del nitrógeno. Sin embargo, el NO2 no reacciona en la troposfera, sino que asciende hasta la estratosfera donde se rompe por fotolisis.
El amoniaco NH3 es el gas básico más importante de la atmósfera. Viniendo, por ejemplo, de la agricultura y la fertilización, y también de la degradación microbiológica (bacterias), puede formar sales de NH4NO3 junto con el ácido nítrico.
|
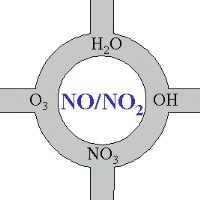
Los óxidos de nitrógeno, cruce de caminos de la química atmosférica
Con una visión amplia de los óxidos de nitrógeno, podríamos decir que, en cierto modo, estos compuestos son el corazón de la química atmosférica. La mayor parte de los compuestos químicos que son oxidados y eliminados de la atmósfera o transformados en otros compuestos entran en contacto, directa o indirectamente, con NO o NO2.
|
 |
 |
 |
|
4. Los óxidos de nitrógeno - en el centro de la química atmosférica
imagen: Elmar Uherek
|
|
Sobre esta página:
autor: Dr. Elmar Uherek - MPI for Chemistry, Mainz
supervisor científico: Dr. Rolf von Kuhlmann, MPI for Chemistry, Mainz
corrección pedagógica: Michael Seesing - Uni Duisburg - 02-07-2003
última revisión y publicación: 30-04-2004
|
|
 |
|







