|
|
 |
|
|
|
 |
| |
|
|
 |
Baja Atmósfera
Saber más |
Condiciones y química de la noche
La química que tiene lugar en la atmósfera no sólo depende de los compuestos emitidos sino también de las condiciones en que se encuentre la atmósfera, es decir, de las estaciones, el cambio del día a la noche, el perfil de temperatura, la humedad, ...
|
|
|
|
|
 |
 |
 |
|
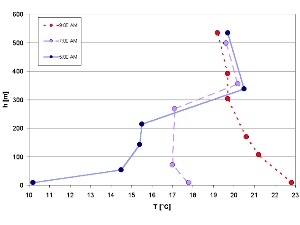
1. Disolución de la inversión térmica en una mañana de Julio (medido el el Valle Isar / Alemania)
por Elmar Uherek adaptado de: Schirmer - Wetter und Klima - Wie funktioniert das?
¡Pincha para ampliar (50 K)!
|
|
 |
Ciclo diurno
En la última sección veíamos el ciclo diurno del OH, el cual dependía de la luz del sol. Pero los compuestos químicos no sólo tienen ciclos diurnos, ya que hay otras condiciones en la atmósfera que les afectan, como por ejemplo el perfil de temperaturas. Las condiciones cerca del suelo, en la llamada "capa fronteriza planetaria", varían y no siempre siguen las reglas generales (por ejemplo, la disminución de la temperatura al aumentar la altura) por las interacciones con la superficie terrestre. Un ejemplo muy típico es el de la capa de inversión térmica que sucede normalmente por la mañana.
|
Inversión nocturna en la capa fronteriza planetaria
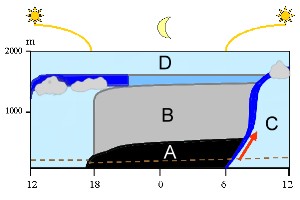
Las masas de aire que se encuentran por debajo de la troposfera libre (D) pertenecen a la capa fonteriza planetaria. A lo largo del día ocurren algunos cambios (de izquierda a derecha): Al mediodía el aire está mezclado (azul claro). Después de la puesta de sol se forma una capa nocturna estable de baja temperatura (A) y un aire residual permanece encima (B) a una temperatura superior a la de la capa A. El aire de la capa de la superficie (debajo de la línea de puntos marrón) no puede ascender con facilidad a mayores alturas durante la noche ya que el aire que tiene encima no le deja ascender. La energía motriz se pierde. Esta energía vuelve con el amanecer al volver a calentar el Sol la superficie terrestre. El suelo se calienta y el aire empieza a ascender (flecha roja), la capa nocturna estable se abre. Durante el día el aire de las distintas zonas vuelve a mezclarse al calentarse el aire de las zonas bajas y ascender a mayor altitud (C).
|
 |
 |
 |
|
2. Modelo de la capa fronteriza planetaria. El grosor de la capa fronteriza planetaria puede variar.
por Elmar Uherek, adaptado de Stull 1988
¡Pincha para ampliar! (70 K)
|
|
En invierno puede pasar que el sol no sea capaz de disolver la capa de inversión en uno o varios días. En esos casos, la contaminación se acumula sobre las ciudades y conduce a la formación de smog. También se dan con frecuencia condiciones especiales en los valles, como se muestra en la fotografía. La inversión permanece bajo una capa de nubes.
|
 |
 |
 |
|
3. Capa de inversión en invierno en las montañas
© Inst. for geographical education, Univ. of Erlangen-Nürnberg
|
|
 |
 |
|
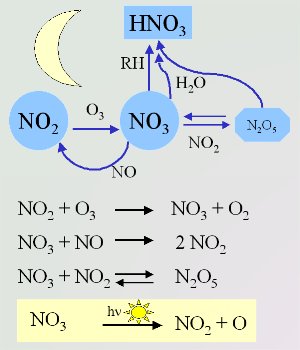
4. Reacciones importantes del nitrato durante la noche(fotólisis diurna en el recuadro amarillo)
Esquema por Elmar Uherek
|
|
 |
Química del nitrato
Como por la noche las condiciones son distintas, también la química es distinta. Por la noche, hay menos posibilidades de que se den reacciones del OH y los radicales nitrato con especies orgánicas en comparación con las que el OH realiza durante el día. Los radicales nitrato NO3 se forman a partir de la reacción del ozono O3 con dióxido de nitrógeno NO2 (Bases, Unidad 3). Éste reacciona de nuevo con NO. Por esto nunca pueden coexistir NO y NO3 a altas concentraciones. La reacción de NO3 y NO2 es el único modo de formar N2O5 en la atmósfera. Éste puede hidrolizarse con agua o descomponerse de nuevo en NO2 y NO3.
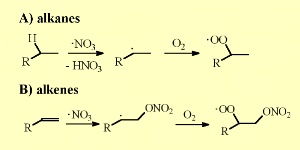
Al igual que el OH, los radicales nitrato sustraen un átomo de hidrógeno de los alcanos. Se forman ácido nítrico y radicales alquilo R• que reaccionan con el oxígeno del aire y forman radicales peróxido RO2•.
|
El NO3, al igual que el OH, tiende a realizar reacciones de adición al doble enlace de los compuestos orgánicos insaturados, formándose peróxidos de nitrato después de la adición de O2. Es importante destacar que el tiempo de vida del NO3/N2O5 disminuye drásticamente al aumentar el vapor de agua. De la reacción del N2O5 con agua se forma HNO3, reacción que ocurre principalmente en las finas películas líquidas que hay sobre las superficies.
Todos los peróxidos que provienen de las reacciones de •OH, NO3 u ozono experimentan procesos muy complicados y numerosos en la atmósfera con O2, HO2•, NO o NO2, produciendo alcoholes, aldehidos, nitratos y ácidos carboxílicos.
Iría más alla del objeto de esta introducción dar más detalles sobre todas estas reacciones, que solo han sido investigadas parcialmente.
|
 |
 |
 |
|
5. Reacciones del nitrato con alcanos y alquenos
¡Pincha para ampliar (30 K)!
|
|
 |
 |
|
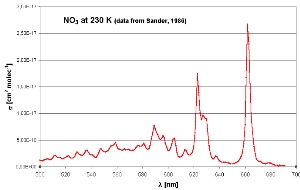
6. Espectro de absorción del nitrato en el rango visible, con máximo de absoción en la parte del rojo del espectro (600-700 nm)
adaptado de Sander (1986), 230 K
|
|
 |
El NO3 absorbe radiación en la parte roja del espectro visible. Tan pronto como llega la luz del día, se rompe por fotolisis produciendo principalmente NO2 y O, y la química del OH domina de nuevo. El ozono, el tercer oxidante de la atmósfera más importante, no reacciona con alcanos pero si con alquenos si la concentración de OH disminuye bajo condiciones de relativa oscuridad (invierno o tarde-noche). Un capítulo especial tratará sobre las reacciones del ozono.
|
Sobre esta página:
autor: Dr. Elmar Uherek - MPI for chemistry, Mainz
supervisor científico: Dr. Mark Lawrence - MPI for chemistry, Mainz 05-05-2004
corrección pedagógica: Michael Seesing - Uni Duisburg - 02-07-2003
última revisión y publicación: 07-05-2004
|
|
 |
|







