|
 Vom Schwefeldioxid zur Schwefligen Säure Vom Schwefeldioxid zur Schwefligen Säure
Gelangt Schwefeldioxid in Wasser, bildet es eine saure Lösung, die Schweflige Säure:
H2O + SO2 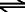 H2SO3 H2SO3
Die Schwefelige Säure bildet in Wasser H+(aq)-Ionen und es entstehen zwei Arten von Säurerestanionen:
H2SO3 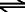 H+(aq) + HSO3-(aq) H+(aq) + HSO3-(aq)
Schweflige Säure reagiert zu einem Proton und einem Hydrogensulfition.
HSO3-(aq) 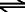 H+(aq) + SO32-(aq) H+(aq) + SO32-(aq)
Ein Hydrogensulfition reagiert zu einem Proton und einem Sulfition.
Aus einem Molekül Schwefliger Säure können also zwei Protonen abgespalten werden. Deshalb wird die Schweflige Säure auch als zweiprotonige Säure bezeichnet.
Allerdings handelt es sich bei der Schwefligen Säure um eine unbeständige Säure. Das heißt, dass sie schon bei Zimmertemperatur wieder in Schwefeldioxid und Wasser zerfällt..
 Schwefelsäure Schwefelsäure
Bei der Verbrennung von Schwefel und auch bei Oxidationsreaktionen in der Luft entsteht nicht nur Schwefeldioxid, sondern auch Schwefeltrioxid. Die bei der Verbrennung entstehende Menge an Schwefeltrioxid ist stark temperaturabhängig, da es oberhalb von 600°C in Schwefeldioxid und Sauerstoff zerfällt:
2 SO3 -> 2 SO2 + O2 (bei T > 600°C)
Schwefeltrioxid bildet mit Wasser zunächst Schwefelsäure:
SO3 + H2O 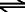 H2SO4 H2SO4
Auch die Schwefelsäure ist eine zweiprotonige Säure, die bei Zugabe von weiterem Wasser in Protonen und Säurerestanionen zerfällt.
H2SO4 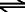 H+(aq) + HSO4-(aq) H+(aq) + HSO4-(aq)
Schwefelsäure reagiert zu einem Proton und einem Hydrogensulfation.
HSO4-(aq) 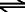 H+(aq) + SO42-(aq) H+(aq) + SO42-(aq)
Ein Hydrogensulfation reagiert zu einem Proton und einem Sulfation.
|







