|
|
 |
|
|
|
 |
| |
|
|
 |
Nedre atmosfære
Innføring |
Nitrogenoksider
Nitrogenoksider spiller en viktig rolle i atmosfæriske prosesser. Hvordan oppstår de og hvorfor er de viktige?
|
1. Trafikk – fortsatt en viktig utslippskilde til nitrogenoksider.
(c) FreeFoto.com |
|
|
|
|
 |
Hvor kommer nitrogenoksidene fra?
De viktigste nitrogenoksidene er nitrogenmonoksid NO og nitrogendioksid NO2. Nitrogenoksidene har fellesbetegnelsen NOx. Nitrogenmolekylene (N2) i lufta er veldig stabile og er vanskelige å oksidere. Noen bakterier har utviklet spesielle mekanismer for å bryte ned trippelbindingen mellom nitrogenatomene og danne oksiderte forbindelser. Men mye viktigere er prosessene der bindingene brytes ned av varme. Dette forekommer bare under ekstreme forhold, for eksempel ved forbrenningen av drivstoff i en bilmotor. Mesteparten av de antropogene (= menneskeskapte) NOx-utslippene kommer fra denne kilden. Det kan også skje i svært varme reaksjoner, som i de varmeste delene av flammene som springer ut av brennende biomasse. Lynnedslag er også en viktig kilde til NOx. I selve lynet kan temperaturen komme opp til 30,000oC og kan lett bryte opp nitrogenbindinger.
2. høyre: Lynnedslag er en annen viktig kilde til nitrogenoksider.
Foto: Bernard Mühr  Karlsruher Wolkenatlas Karlsruher Wolkenatlas
|
 |
|
 |
 |
|
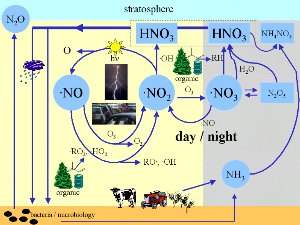
3. Hvor er nitrogenoksider involvert i atmosfæriske prosesser? Figuren gir en enkel (men ikke fullstendig) oversikt over viktige prosesser i atmosfærisk kjemi. av Elmar Uherek for ESPERE.
Klikk for å forstørre!
|
|
 |
Hvor er nitrogenoksidene virksomme?
Vi finner nitrogenoksider nesten overalt i atmosfæren. Om natta dannes det NO3-radikaler, som er de mest aktive oksidantene. Radikaler er en type kjemikalier som er svært ustabile og vanligvis reagerer ekstremt fort. Hvis N2O5 dannes i forurensede områder, kan det reagere med vann i små dråper eller på våte overflater og danne salpetersyre (HNO3). HNO3 bidrar til å gjøre nedbøren sur. Salpetersyre, som også kan oppstå på dagtid ved oksidasjon av NO2, er det viktigste produktet når nitrogenoksidene fjernes fra lufta. Salpetersyre finnes også i de polare stratosfæriske skyene. Salpetersyretrihydrat (HNO3x3H2O) danner partiklene som ozonhullet utviklet seg fra.
|
|
Navn på nitrogenforbindelser:
:
|
Formel |
Systematisk Navn |
Trivialnavn |
|
NO |
nitrogenmonoksid |
nitrogenoksid |
|
N2O |
dinitrogenmonoksid |
lystgass |
|
NO2 |
nitrogendioksid |
- |
|
N2O5 |
dinitrogenpentoksid |
salpetersyrlinganhydrid |
|
N2O3 |
dinitrogentrioksid |
- |
|
HNO3 |
- |
salpetersyre |
|
NH3 |
- |
ammoniakk |
|
|
Nitrogenoksider i gassform er svært viktige for dannelsen og nedbrytningen av troposfærisk ozon, fordi de er involvert i katalytiske sykluser. Denne skyldes først og fremst at NO2 kan bli spaltet av sollyset (fotolyse). Det danner NO som igjen oksiderer til NO2. Både ozon og peroxy-radikaler (ustabile oksiderte forbindelser) kan være involvert i denne syklusen, som vi skal se i neste tekst. Den viktigste grunnen til at katalysatoren for biler ble oppfunnet, var å unngå store utslipp av nitrogenoksider. Vi slipper ut for mye av dem i forbrenningsprosesser, spesielt i biler, og forstyrrer likevekten i lufta. N2O dannes for eksempel av bakterier i såkalte nedbrytingsprosesser. Mikrobiologien i slike små organismer spiller en stor rolle i nitrogensyklusen. Men N2O reagerer ikke i troposfæren. Det går direkte opp i stratosfæren, der det spaltes av sollyset (ved fotolyse).
Ammoniakk NH3 er den viktigste basiske gassen i atmosfæren. Den kommer blant annet fra kveghold, gjødsel og mikrobiologisk nedbrytning (bakterier) og kan danne saltpartikler NH4NO3 sammen med salpetersyre.
|
Nitrogenoksider ved den atmosfæriske kjemiens korsvei
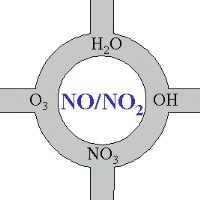
Selv om vi her ikke kommer nærmere på nitrogenoksidenes kjemi, kan vi huske på at disse forbindelsene på en måte er i sentrum av den atmosfæriske kjemien. En stor del av de kjemiske forbindelsene som oksideres og fjernes fra atmosfæren eller omdannes til andre forbindelser, kommer i kontakt med NO eller NO2 direkte eller indirekte.
|
 |
 |
 |
|
4. Nitrogenoksider – i sentrum av atmosfærisk kjemi.
Bilde: Elmar Uherek.
|
|
Om denne siden:
forfatter: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz
vitenskapelig kvalitetssikring: Dr. Rolf von Kuhlmann, Max Planck Institute for Chemistry, Mainz
pedagogisk utprøving: Michael Seesing - Uni Duisburg - 2003-07-02
sist oppdatert: 2004-04-30
Oversatt og bearbeidet av Nicolai Steineger og Erik Steineger
|
|
 |
|







