|
|
 |
|
|
|
 |
| |
|
|
 |
Baja Atmósfera
Saber más |
Técnicas de medida - la espectroscopía
La mayoría de los gases traza de la atmósfera se encuentran en concentraciónes de menos de una millónesima parte. ¿Cómo podemos saber la concentración exacta?¿Qué técnicas de medida se utilizan normalmente?
|
|
|
|
|
 |
|
Para analizar el aire, tanto en el laboratorio como en el exterior, las técnicas que suelen utilizarse son dos:
a) espectroscopía - detecta las interacciones de las moléculas con la luz
b) cromatografía - detecta las interacciones de las moléculas con otras moléculas
|
|
|
 |
El carácter de la radiación
Por las experiencias que tenemos en nuestra vida cotidiana con radios, microondas, salas de bronceado y diagnósticos por rayos X, sabemos que existen muchas ondas electromagnéticas en el aire, todas con diferente energía y sólo algunas de ellas visibles como luz. Todas las ondas juntas forman el espectro electromagnético. La energía de estas ondas va aumentando en el siguiente orden: ondas de radio, microondas, luz infrarroja, luz visible, luz ultravileta (UV) y rayos X. A menor longitud de onda, mayor frecuencia y mayor energía. Casi todas esas ondas interaccionan con las moléculas del aire, y según el camino que realizan podemos saber qué molécula ha causado la interacción.
|
|
Longitud de onda, frecuencia y energía de las diferentes regiones del espectro electromagnético:
|
|
Long. de onda (m) |
Frecuencia(Hz =s-1) |
Energía (J) |
|
Radio |
> 1 x 10-1 |
< 3 x 109 |
< 2 x 10-24 |
|
Microondas |
1 x 10-3 - 1 x 10-1 |
3 x 109 - 3 x 1011 |
2 x 10-24- 2 x 10-22 |
|
Infrarrojo |
7 x 10-7 - 1 x 10-3 |
3 x 1011 - 4 x 1014 |
2 x 10-22 - 3 x 10-19 |
|
Visible |
4 x 10-7 - 7 x 10-7 |
4 x 1014 - 7.5 x 1014 |
3 x 10-19 - 5 x 10-19 |
|
UV |
1 x 10-8 - 4 x 10-7 |
7.5 x 1014 - 3 x 1016 |
5 x 10-19 - 2 x 10-17 |
|
Rayos X |
1 x 10-11 - 1 x 10-8 |
3 x 1016 - 3 x 1019 |
2 x 10-17 - 2 x 10-14 |
|
Rayos gamma |
< 1 x 10-11 |
> 3 x 1019 |
> 2 x 10-14 |
|
La interacción de la luz y las moléculas
Si una onda se encuentra con una molécula en el aire, puede transferir su energía a la molécula, la cual cambiará de estado. Para cambiar el estado rotacional de una molécla hace falta menos energía que para hacer girar sus enlaces, y todavía más energía se necesita para transferir electrones a otro orbital alrededor del núcleo atómico. Todo esto depende de los átomos de la molécula, su tamaño y la fuerza de sus enlaces. Moléculas concretas consumen fracciones concretas del espectro electromagnético para producir cambios concretos en sus estados. Por lo tanto, si emitimos una radiación a través del aire y comparamos esa radiación antes y después de atravesar esa masa de aire, veremos que ciertas fracciones de la radiación han sido absorbidas (consumidas) por la moléculas, y según como haya sido la absorción podremos caracterizar las moléculas y saber su concentración.
|
|
|
 |
Asumamos que emitimos de una fuente de luz infrarroja (S) de diferente energía (E) una radiación a traves de una parcela de aire y medimos la fracción de la luz que alcanza el detector (D). Las diferentes energías (= diferntes longitudes de onda) se muestran en distintos tonos de rojo.
|
|
|
 |
Una molécula absorbe una enegía concreta (dos de las seis energías distintas son interceptadas) y esta luz no alcanza el detector. Si restamos el espectro original sin la molécula del espectro con la molécula , aparece un pico de absorción, que se muestra a a derecha. El pico representa la luz perdida, así que cuanta más luz se absorba, mayor será el pico (ver figura 2d).
|
 |
 |
|
2. a-c) Animaciones por Elmar Uherek
¡Pincha para ampliar! (30 K)
|
|
 |
Suponemos otra molécula que también absorbe luz, pero que necesita más energía para hacer girar al enlace. El pico de absorción aparece a otra energía (longitud de onda) del espectro.
|
 |
 |
|
2. d) En contraste con las tres imágenes anteriores, aquí nos centramos solo en un pequeño rango de energía (todas las flechas tienen el mismo color = prácticamente la misma energía), por ejemplo la energía de absorción de la primera molécula. La suavidad del color al llegar al detector, representa que la luz que llega al detector es menor cuantas más moléculas tenemos. La altura de la banda de absorción (esta es un banda negativa, que nos indica que la energía que llega al detector es menor) crece.
|
|
 |
A partir del espectro no sólo obtenemos información sobre qué moléculas hay en el aire (posición de la banda de absorción), sino que también, con la intensidad de la banda de absorción podemos saber cuántas moléculas hay en el aire, ya que la retención de radiación es proporcional al número de moléculas.
|
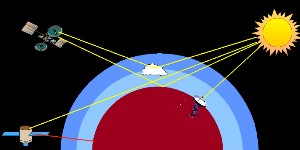
En la atmósfera hay varias posibilidades para medir la absorción de luz. En la Tierra la absorción de luz del sol o de la luna puede medirse (rango UV-VIS). La radiación infrarroja que emite la Tierra se mide con satélites, que también pueden medir la radiación del sol que reflejan la Tierra o las nubes o la que pasa tangente a la superficie terrestre.
|
 |
 |
 |
|
3. Medición de satélite de la absorción en la atmósfera
imagen por Elmar Uherek
|
|
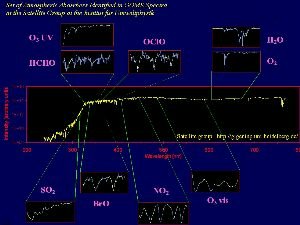
Hoy en día, la radiación infrarroja que emite la Tierra (temperatura de la superficie) se mide con satélites. Pero también muchos compuestos inorgánicos importantes como el ozono, los óxidos de nitrógeno o los óxidos de halógenos pueden observarse desde el espacio. Un ejemplo de estas medidas es el Global Ozone Monotoring Experiment (GOME). No sólo se mide el ozono, sino que también se miden el agua, el NO2, el SO2 y el formaldehido (HCHO). El sistema GOME se encuentra en el satélite ERS-2 y toma el espectro en el rango UV-visible e infrarrojo cercano (240-790 nm).
|
 |
 |
 |
|
4. Espectros de varios compuestos inorgánicos en la atmósfera tomados por satélite, por el sistema GOME.
fuente: Satellite group IUP Heidelberg
¡Pincha para ampliar! (150 K)
|
|
 |
 |
|
5. a+b) Atención: la radiación infrarroja no es visible. Aquí el rayo puede verse solo porque la fuente de la radiación emite también en la parte roja del espectro visible.
|
|
 |
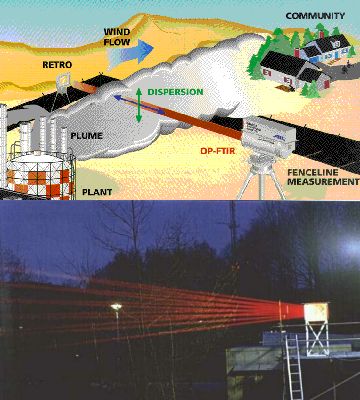
De todas formas, la fuente de radiación y el detector también se pueden instalar los dos en el suelo. Como no pueden estar muy separados uno de otro y como las concentraciones son muy pequeñas, se usan complicados espejos ópticos (por ejemplo los llamados Células blancas) para reflejar la radiación varias veces y aumentar la longitud del camino de la luz a través de la atmósfera. La imagen de la izquierda muestra el montaje en teoría (imagen de EPA Field Analytik Technology Enyclopaedia) y en práctica (foto de FZ Jülich). Aquí se usa la espectroscopía infrarroja y debajo se da un simple ejemplo de un espectro.
|
|
|
 |
Vibraciones:
A Estiramiento asimétrico

B Estiramiento simétrico
[IR no activo]

C curvamiento vertical

D curvamiento horizontal

|
Sobre esta página:
autor: Dr. Elmar Uherek - MPI for Chemistry, Mainz
supervisor científico: Dr. Mark Lawrence - MPI for Chemistry, Mainz - 05-05-2004
corrección pedagógica: Michael Seesing - Univ. of Duisburg - 02-07-2003
última revisión y publicación: 10-05-2004
|
|
 |
|







