|
|
 |
|
|
|
 |
| |
|
|
 |
Baja Atmósfera
Saber más |
Hoja de ejercicios 2
La interrelación entre luz, absorción y color
|
|
|
|
|
 |
 |
 |
|
Figura 1: espectro de la luz blanca
© 2004 Seesing, Tausch; Universität Duisburg-Essen, Duisburg [Lit:Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993]
|
|
La luz visible es una parte del espectro de la radiación electromagnética. Ésta consiste en pequeñísimas unidades de energía llamadas cuantos de luz o fotones. La energía de un foton está determinada por su longitud de onda. Si la misma cantidad de fotones de todas las longitudes de onda del espectro visible llegan a nuestros ojos, nosotros percibimos la luz como luz blanca. De igual modo un objeto se ve blanco si refleja todos los distintos fotones en los que consiste la luz blanca en una camino regular. Con un prisma o una red de difracción (un gran número de finas líneas paralelas, por ejemplo un CD) las longitudes de onda pueden pasar o ser reflejadas con diferentes ángulos, de forma que veremos un espectro con todos los colores ordenados de acuerdo con su energía (figura 1). Si una parte de la luz de una cierta energía es absorbida, nosotros percibiremos el color complementario de la luz absorbida.
|
|
|
T 1 |
¿Cuál de los colores visibles pertenece a cada uno de los espectros de debajo? |
|
espectros |
color resultante | |
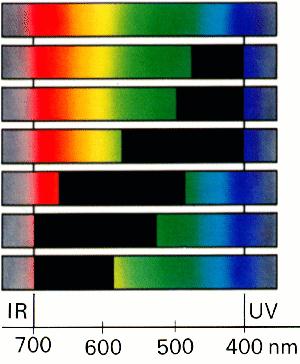 |
 |
|
© 2004 Seesing, Tausch; Universität Duisburg-Essen, Duisburg [Lit:Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993]
|
|
 |
|
|
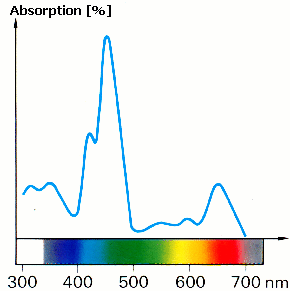
En la naturaleza muchas cosas aparecen con color. La mayoría de ellas absorben en varias regiones del espectro visible. Normalmente la absorción en esas regiones no es de la misma cantidad (figura 2). Ésto produce espectros de absorción característicos que pueden ser usados para identificar sustancias. Además, dos sustancias hechas de los mismos componentes pueden a veces tener distinta luminosidad.
|
|
T 2 |
Propon una hipótesis de por qué dos muestras de la misma sustancia aparecen con distinto brillo y da razones para tu hipótesis. Dibuja el espectro de una clorofila b "más oscura" en la figura 2. |
|
 |
 |
 |
|
Figura 2: espectro de absorción de una muestra de clorofila b
© Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993
|
|
|
Espectrometría básica
La espectroscopía se usa para la identificación de sustancias. En el laboratorio puedes examinar distintas sustancias con un fotómetro (también llamado espectrómetro) para poder encontrarlos luego en una medición por satélite de la atmósfera de la Tierra. (el espectro de la atmósfera realizado por el satélite GOME en las webs de ESPERE: sección en "Baja Atmósfera / más / 1. Oxidantes".)
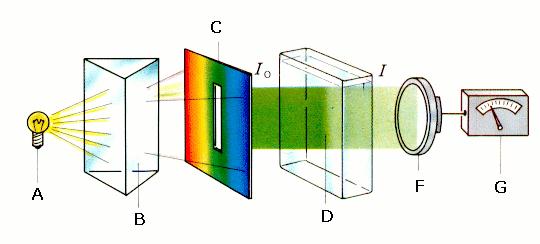
Un fotómetro está formado por los elementos que se muestran en la figura 3:
|
 |
 |
|
Figura 3:
Montaje de un fotómetro. A: fuente de luz (lámpara); B: monocromador (prisma o red de difracción); C: apertura; D: cubeta con muestra; F: fotosensor; G: amplificador con lector calibrado que muestra la EXTINCIÓN; Io: intensidad de la radiación antes de la muestra; I: intensidad de la radiación despues de atravesar la muestra. El valor medido, la EXTINCIÓN, da la relación entre la intensidad que ha pasado (I) y la intensidad original (Io).
© 2004 Seesing, Tausch; Universität Duisburg-Essen, Duisburg [Lit:Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993]
|
Dependiendo de los aparatos y la afinación, la medidas están expresadas en porcentaje o logarítmicamente.
|
 |
|
|
Hay muchos parámetros que pueden ajustarse en un fotómetro. Se puede elegir entre distintas lámparas, especialmente en los aparatos que también trabajan en la región del UV del espectro electromagnético, o la anchura de la apertura, la posición del monocromador, la temperatura de la muestra, y la amplificación. También se puede cambiar el grosor de la muestra utilizando cubetas de diferentes geometrías
|
T 3 |
Qué tienes que cambiar exactamente y continuamente para obtener un espectro como el que se muestra en la figura 2? Razona tu respuesta. | |
|
Los científicos Johann Heinrich Lambert (1728-1777) y August Beer (1825-1863) establecieron una ley que fue llamada como de ellos, la ley de Lambert y Beer:
|
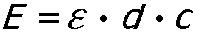 |
 |
|
E: extinccion; å coeficiente de extincion molar (constante que depende de las longitudes de onda y del caracter de la sustancia absorbente); d: grosor de la muestra; c: concentracion de la sustancia absorbente.
|
|
T 4 |
Interpreta tu respuesta en T2 teniendo en cuenta la ley de Lambert y Beer. ¿Qué proporcionalidad en relación a la extinción puede obtenerse experimentalmente y usarse? |
|
T 5 |
¡Discute tus resultados de T3 y T4! |
|
|
Sobre esta página:
Autores: M. Seesing, M. Tausch - Universität Duisburg-Essen, Duisburg / Alemania
Supervisor científico: Dr. Mark Lawrence - MPI for chemistry, Mainz - 05-05-2004
Última actualización: 13-05-2004
|
|
 |
|







