|
|
 |
|
|
|
 |
| |
|
|
 |
Baja Atmósfera
Saber más
|
La oxidación en la atmósfera
Numerosos compuestos químicos se emiten a la atmósfera, y si no hubiera un modo de eliminarlos se acumularían. Esta eliminación de compuestos puede ocurrir por sedimentación seca o por sedimentación húmeda (gracias al lavado de la lluvia) . En concreto, la eliminación de los compuestos orgánicos gaseosos es más sencilla si se transfieren a un estado oxidado, soluble en agua y menos volátil.
|
|
|
|
|
 |
 |
 |
|
1. El OH limpia el aire
imagen: Elmar Uherek
|
|
 |
La oxidación, en un sentido químico, no se refiere necesariamente a la reacción de compuestos que contengan oxígeno. Pero en el aire, en la mayoría de los casos el oxígeno está implicado. Estos son los principales oxidantes, que gobiernan la mayoría de los procesos en la atmósfera:
el radical hidroxilo OH
el radical nitrato NO3
la molécula de ozono O3
Los radicales HO2 también son importantes y a veces la suma de OH y HO2 se llama HOx. No obstante, el oxidante más importante es el radical hidroxilo, que es extremadamente reactivo y capaz de oxidar casi todos los compuestos químicos que se forman en la atmósfera.
Es por esto que el OH se llama "el detergente de la atmósfera".
|
Sólo algunos compuestos como los clorofluorocarburos CFCs (por ejemplo CF2Cl2), el óxido nitroso N2O o el dióxido de carbono son muy estables y no reaccionan del todo con el OH o reaccionan muy lento. También la tasa de reacción del metano CH4 es entre 100 y 1000 veces menor comparado con otros compuestos orgánicos. Esto explica la razón por la que las concentraciones de metano (alrededor de 1.7ppm = 1.7 mlmol/mol) pueden ser bastante altas, mientras que las concentraciones de la mayoría de los gases traza orgánicos son menores de 1ppb (= 1nmol/mol)*.
|
 |
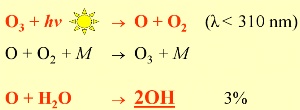 |
 |
|
2. Formación deOH: >97% de los átomos de O formados por la fotolisis del ozono,reaccionan formando de nuevo ozono. Sólo <3% inicia la formación del radical más importante de la atmósfera: el OH.
Si dos moléculas A y B chocan y forman una molécula C, es necesaria otra molécula que elimine el exceso de energía. Esta molécula (normalmente N2) no reacciona por si sola.
|
|
 |
 |
|
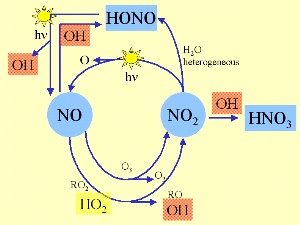
3. Ciclo del OH y el óxido de nitrógeno
Esquema por Elmar Uherek
Pincha para ampliar (90 K)
|
|
 |
¿Cómo se forma el OH?
El OH gobierna la química atmosférica durante el día porque su formación depende fundamentalmente de la radiación del sol. La reacción inicial (arriba) es la ruptura del ozono por la luz del sol (fotolisis) a longitudes de onda menores de 310 nm, seguido de la reacción del átomo de O formado, con agua. Por eso es necesaria una cierta cantidad de ozono en la troposfera para su química, aunque mucho es perjudicial para la salud.
Otras fuentes de OH son la fotólisis del ácido nitroso HNO2, el peróxido de hidrógeno H2O2 y el peroxi metano H3OOH, la reacción del NO con el radical hidroperoxi HO2 o la reacción de alquenos con ozono. El esquema de la izquierda muestra el modo en que el OH se entrelaza con los ciclos de reacciones diurnos de los óxidos de nitrógeno. |
¿Cuánto OH se forma?
Dado que el OH es un radical extremadamente reactivo nada más formarse reacciona. Tiene una vida de un segundo o menos. Esto quiere decir que su concentración es muy baja, entre 1x105 y 2x107 moléculas por cm3. A la presión del nivel del mar se encuentra en un ratio de 0.1 - 1 ppt (pmol/mol).
Como su formación depende de la disponibilidad de vapor de agua, la concentración de OH disminuye con la altura (el aire se hace cada vez más frío y seco).
|
 |
 |
 |
|
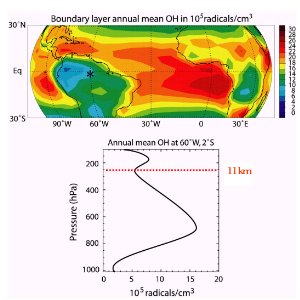
4. Distribución de OH por zonas.
Una presión de 250 hPa se alcanza aproximadamente a 11 km de altitud (tropopausa en latitudes medias). Cuales son las altitudes para 1000, 800, 600 y 400 hPa? ¡Usa el diagrama de la relación presión altitud!
fuente: presentation J. Lelieveld - MPI Mainz 2003
Pincha para ampliar (80 K)
|
|
Pero en particular disminuye con la latitud porque a medida que nos acercamos a los polos no solo disminuye la concentración de vapor de agua sino también la intensidad y la duración de la luz solar.
¿Cómo reacciona el OH?
La imagen de la derecha muestra un efecto muy interesante sobre la selva tropical. La concentración de OH disminuye cerca del suelo. ¿Cuál es la razón? Muchos compuestos orgánicos, sobre todo el isopreno, son emitidos por el bosque y reaccionan con el OH, por lo que tiene lugar una fuerte eliminación de OH cerca del suelo.Se consume en reacciones químicas. El OH presenta una fuerte tendencia a captar un átomo de hidrógeno de los compuestos orgánicos RH, siempre que sea posible, para formar agua H2O. A continuación el radical R• reacciona con oxígeno dando lugar a peróxidos orgánicos, que por ejemplo son necesarios para el ciclo de formación del ozono.
|
 |
 |
 |
|
5. Distribución de OH en los trópicos
arriba: distribución global en las regiones tropicales
abajo:perfil sobre la estación de la selva tropical de Manaus (Brasil)
Fuente: presentación J. Lelieveld MPI Mainz 2003
Pincha para ampliar (80 K)
|
|
|
Sin embargo, los compuestos orgánicos de los bosques no son los principales compuestos con los que reacciona el OH. Los gases orgánicos contribuyen con un 30% a la eliminación del OH, y un 15% más del metano, la más importante y pequeña de las moléculas orgánicas. El principal gas que reacciona con el OH es el monóxido de carbono (40%), y el restante 15% reacciona con el ozono O3, los radicales peroxi HO2 y el hidrógeno H2.
|
 |
 |
|
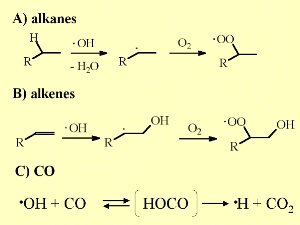
6. Reacciones importantes del OH en la troposfera.
Pincha para ampliar (45 K)
|
|
 |
Cuando reacciona con alquenos pequeños, un tipo de compuestos orgánicos, el OH tiende a adicionarse al doble enlace siempre que el resto de cadena saturada no sea muy grande y la abstracción de H esté estadísticamente favorecida. También aquí se forman peróxidos. El OH es capaz de oxidar el monóxido de carbono CO a dióxido de carbono CO2. Como vimos el CO y el metano CH4, son los principales sumideros de OH. Otros compuestos reactivos están disponibles en muy pequeñas cantidades del orden ppt, mientras que el CO alcanza niveles medios de 120 ppb en el hemisferio norte (más procesos de combustión) y 60 ppb en el hemisferio sur.
|
Aunque el OH es el oxidante más importante de la atmósfera, su concentración durante la noche es cercana a cero, ya que para formarse necesita radiación solar. Y por ésto, durante la noche y los periodos oscuros la química del nitrato NO3 y el ozono O3 toma más importancia.
|
 |
 |
 |
|
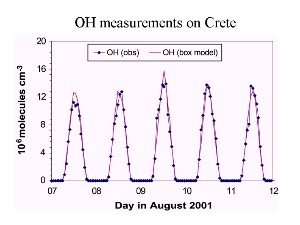
7. Perfil en el tiempo de la concentración de OH en varios días.
Fuente: Presentación J. Lelieveld MPI Mainz 2003
|
|
* El ratio de mezcla ppb o ppm (= 1 molécula entre 1 billón de moléculas, o 1 molécula entre 1 millón de moléculas) se usa frecuentemente en publicaciones científicas al igual que en la literatura de la ciencia climática y atmosférica. Nosotros también lo utilizamos en la Enciclopedia Climática. Sin embargo, es más correcto utilizar la unidad 1 nmol/mol (= 1ppb) o 1 mlmol/mol (= 1 ppm), ya que la cantidad de moléculas n se mide en la unidad mol.
|
Sobre esta página:
autor: Dr. Elmar Uherek - MPI for chemistry, Mainz
supervisor científico: Dr. Mark Lawrence - MPI for chemistry, Mainz 05-05-2004
corrección pedagógica: Michael Seesing - Uni Duisburg - 02-07-2003
última revisión y publicación: 07-05-2004
|
|
 |
|







