|
|
 |
|
|
|
 |
 |
|
|
 |
Grundlagen B1: Phasenübergänge
 Wie funktioniert ein Gas? Wie funktioniert ein Gas?
Der gasförmige Zustand erscheint uns wenig „greifbar“. Doch sind auch Gase nur deshalb Gase und nicht Flüssigkeiten oder Feststoffe, weil in ihrer Umgebung soviel Energie (Wärme) vorhanden ist, dass sich die einzelnen Gasteilchen nicht zusammenfügen können.
|
Stelle dir einen Raum vor mit einem vibrierenden Boden, in dem viele Bälle liegen, die durch die Vibration des Bodens ständig hochgeschleudert werden. Der ganze Raum ist mit fliegenden Bällen gefüllt. So in etwa funktioniert es auch mit einem Gas. Den Zustand ständiger Mobilität, den wir bei Teilchen aufgrund der vorhandenen Wärme finden, bezeichnen wir als Brown`sche Molekularbewegung.
|
 |
 |
 |
|
1. Bildschirmkopie - Illustration der brownschen Molekularbewegung
Bitte anklicken!
|
|
Dies bedeutet aber auch, dass bei sehr niedriger Umgebungsenergie Gase flüssig und fest werden können. Kohlendioxid kann man als Trockeneis in Blöcken kaufen. Es wird bei etwa –78°C fest. Selbst der Stickstoff, eines der leichtesten Gase in der Luft, kann bei sehr niedrigen Temperaturen als Flüssigkeit gehalten werden. Stickstoff wird bei –196°C flüssig.
|
 |
 |
|
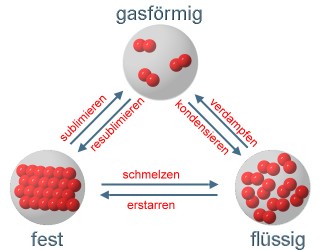
4. Phasenübergänge zwischen den drei Aggregatzuständen; Abbildung: Elmar Uherek
|
|
 |
Wir sehen: Bestandteile der Luft, die bei den auf der Erde auftretenden Temperaturen von –60°C bis +50°C gasförmig sind, können bei sehr niedrigen Temperaturen flüssig oder fest werden.
Wird ein Gas flüssig, so spricht man von Kondensation, wird es fest, so spricht man von Resublimation.
|
|
 Phasenübergänge bei Wasser Phasenübergänge bei Wasser
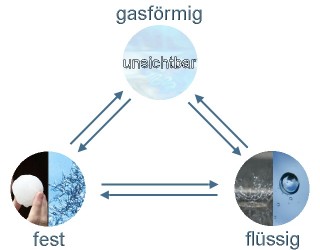
Es fällt nicht schwer uns vorzustellen, dass es Substanzen gibt, denen es in der Luft leichter fällt, fest oder flüssig vorzuliegen, als Stickstoff oder Kohlendioxid. Das am besten bekannte Beispiel ist Wasser.
|
Wasser verdunstet und geht als Wasserdampf in die Luft über. Sehr anschaulich wird dies, wenn nach einem Regenguss im Hochsommer die noch warmen Straßen förmlich dampfen. Der Wasserdampf kondensiert in der Luft und es entstehen Wolkentropfen. Werden sie zu groß, so fallen sie als Regen zu Boden. Hohe Wolken in sehr kalten Luftschichten können aber auch aus Eiskristallen bestehen. Wenn es hagelt oder schneit, erreicht festes Wasser sogar den Erdboden, bevor es geschmolzen ist.
|
 |
 |
 |
|
5. Phasenübergänge beim Wasser: Eis, flüssiges Wasser, Wasserdampf
Abbildung: Elmar Uherek
|
|
|
 |
|







