|
|
 |
|
|
|
 |
 |
|
|
 |
Grundlagen B2: Polarität und Ionen
 Bindung in Salzen? Bindung in Salzen?
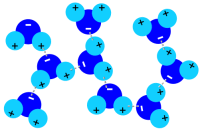
Wasser findet leichter zur Flüssigkeit oder zum Feststoff zusammen, weil sich die kleinsten Teilchen des Wassers anziehen. Wir sagen: Wassermoleküle sind polar. Sie verhalten sich wie kleine Magnete, die aneinander haften.
|
Noch viel besser als dem Wasser gelingt dies den Salzen. Ihre kleinsten Teilchen, die positiven und negativen Ionen, ziehen sich enorm stark an.
Frage deine Eltern nach einem alten Topf, der nicht mehr benötigt wird. Stelle ihn auf den Herd und gib einen Teelöffel trockenes Kochsalz hinein. Stelle den Herd auf die größte Stufe. Was geschieht?
|
 |
 |
 |
|
1. Polare Wasserstoffbrückenbindung in flüssigem Wasser; Abbildung: Elmar Uherek
|
|
Du siehst, dass dem Salz die enorme Hitze nichts ausmacht. Salze lösen sich zwar in Wasser, in trockener Umgebung bilden sie aber sehr stabile Kristalle. Dies liegt daran, dass die einzelnen Teilchen, die Moleküle, in Salzen sehr stark aneinander gebunden sind.
|
 |
 |
|
4. Partikel aus Ammoniumsulfat stark vergrößert
Quelle: PSI
|
|
 |
 Salze in der Luft Salze in der Luft
Wir können uns die kleinsten Teilchen (Ionen) im Kristallgitter eines Salzes wie Kugeln mit stark positiver und negativer Ladung vorstellen, die kaum voneinander zu trennen sind. Sie ziehen sich an, wie sehr starke Magnete. Wenn Salze in die Luft gebracht werden oder durch eine chemische Reaktion in der Luft entstehen, dann verflüchtigen sie sich nicht mehr.
|
|
Sie bilden schwebende Salzpartikel, die Luftfeuchte anziehen können. Mit zunehmender Größe neigen sie dazu, zu Boden zu sinken. Um sehr feine Partikel herzustellen, wird gerne eine chemische Reaktion ausgenutzt, die auch in der Natur die wichtigste Quelle für Partikel ist: Schwefelsäure und Ammoniak bilden Ammoniumsulfatsalze.
|
|
 |
|







