|
|
 |
|
|
|
 |
| |
|
|
 |
Havet
Innføring |
Vannets spesielle egenskaper
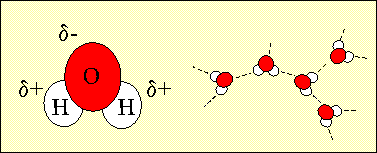
71% av jorda er dekket av vann og 97% av dette vannet finnes i havet. Et vannmolekyl er sammensatt av to hydrogenatomer og et oksygenatom (H2O). På grunn av vannmolekylets elektronstruktur har oksygenatomet en liten negativ ladning, mens hydrogenatomene er litt positive. Når vannmolekylene kommer i nærheten av hverandre, trekkes de positive og de negative delene mot hverandre. Disse sammentrekkende kreftene kalles hydrogenbindinger. Hydrogenbindinger er den viktigste årsaken til vannets svært spesielle egenskaper, og det som gjør liv på jorda mulig.
|
 |
 |
|
1. Strukturen til et vannmolekyl som viser den lille negative ladningen på oksygenatomet, og de små positive ladningene på hydrogenatomene. Fordi hydrogenatomene er ladet på denne måten, kan de danne hydrogenbindinger med andre vannmolekyler. Forfatter: Lucinda Spokes.
|
|
|
|
|
 |
- Vann er det eneste naturlige stoffet som man kan finne både som gass (vanndamp), væske og fast stoff (is) på jorda.
|
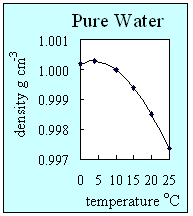
- Tetthet er en måleenhet for hvor kompakt et stoff er. Et stoffs tetthet regnes ut ved å dividere stoffets masse med stoffets volum. Tettheten er nesten alltid høyest i fast stoff, etterfulgt av væske og gass. Når temperaturen øker, synker som regel tettheten. Det eneste unntaket fra denne regelen er rent vann, som har høyest tetthet i flytende form. Rent vann er aller tettest ved en temperatur på 4 oC. Dette er fordi hydrogenbindingene mellom vannmolekylene gir isen en veldig stabil og lite kompakt struktur. Ved lave temperaturer har vannet høyere tetthet enn is, og dette er grunnen til at isen flyter.
|
 |
 |
 |
|
2. Hvordan tettheten i rent vann forandres med temperaturen. Grafen viser at rent vann har høyest tetthet ved 4oC, mens det fortsatt er i flytende form. Forfatter: Lucinda Spokes.
|
|
 |
 |
|
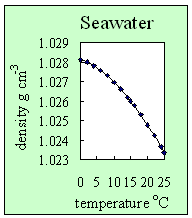
3. Tettheten i sjøvann forandrer seg med temperaturen. Med en fast saltkonsentrasjon (i dette tilfellet en salinitet på 35), blir sjøvannets tetthet mindre jo høyere temperaturen er. Forfatter: Lucinda Spokes.
|
|
 |
- Tilsetter man salt i vannet, blir tettheten større. Det gjør at det ikke dannes hydrogenbindinger fullt så lett. Derfor har sjøvann, i motsetning til rent vann, ikke maksimal tetthet ved 4 oC, men først når det fryser til is. Det er også grunnen til at sjøvann ikke fryser ved 0 oC, men trenger enda lavere temperaturer før det blir til is. Det er derfor vi strør salt på veiene når det kaldt, for å minske faren for isdannelse.
|
- Vann har veldig høy spesifikk varmekapasitet. Det vil si at det trengs store mengder energi for å øke vannets temperatur. Fordi jorda består av 71% vann, forandres temperaturen bare i liten grad av solenergien. Det forhindrer at det blir alt for kaldt eller alt for varmt, og gjør livet på jorda mulig. Varmen blir lagret i havet om sommeren, og sluppet tilbake ut i atmosfæren om vinteren. Havet har derfor den egenskapen at det jevner ut temperaturforskjellene mellom årstidene.
|
 |
 |
 |
|
4. Det brukes fire ganger så mye energi for å varme opp vann 1 oC, enn å varme opp samme mengde luft 1oC. Forfatter: Lucinda Spokes.
|
|
- Vann har også høy fordampingsvarme, som er den varmen som trengs for å omdanne vann til damp. Det trengs derfor svært mye solenergi for å gjøre flytende vann om til gass. Når vanndampen beveger seg fra varme områder til kaldere strøk, går dampen tilbake til væskeform og kan bli til regn. Dermed frigis varme og lufta blir varmere. De enorme mengdene energi som er involvert forårsaker kraftige bevegelser i lufta. Slik blir det vind og stormer på jorda.
- Mange stoffer er oppløselige i vann, og holdes på plass i vannet av hydrogenbindingene. Dette gjør transport av oksygen, karbondioksid, næringsstoffer og avfallsstoffer i vannet mulig, og er grunnen til at biologiske prosesser kan finne sted her.
- Fordi oljemolekyler er store og ikke har noen elektrisk ladning, blir de ikke brutt ned til mindre, ladete molekyler som stabiliseres av vannet. Det vil si at de ikke er vannoppløselige.
|
 |
 |
|
5. Bilde av bølger som bryter over et forskningsskip av Wendy Broadgate. Andre bilder fra NOAA.
|
Om denne siden:
Forfatter: Lucinda Spokes - Environmental Sciences, University of East Anglia, Norwich - U.K.
1. sci. reviewer:
2. sci. reviewer:
edu.reviewer:
Oversettelse: Nicolai Steineger og Erik Steineger
sist oppdatert: 2003-12-10
|
|
 |
|







