|
|
 |
- Woda jest jedyną naturalną substancją na Ziemi, która występuje w postaci gazowej (para wodna), ciekłej lub stałej (lód).
|
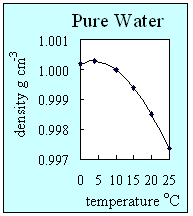
- Gęstość to parametr, który charakteryzuje "upakowanie" materii w danym ciele. Definiujemy ją jako stosunek masy ciała do zajmowanej przez nie objętości w określonej temperaturze. Ciała stałe mają większą gęstość niż ciecze i gazy. Wraz ze wzrostem temperatury gęstość zazwyczaj maleje. Czysta woda jest wyjątkiem od tej reguły. To jedyna substancja, która osiąga najwyższą gęstość w postaci cieczy. Woda ma bowiem największą gęstość przy temperaturze 4°C. Wiązania wodorowe pomiędzy cząsteczkami wody sprawiają, że lód ma bardzo trwałą, uporządkowaną strukturę. W niskich temperaturach woda ma większą gęstość niż lód i dlatego lód pływa w wodzie.
|
 |
 |
 |
|
2. Zależność gęstości czystej wody od temperatury. Czysta woda ma największą gęstość w temperaturze 4oC kiedy znajduje się w stanie ciekłym.
Objaśnienia: pure water - czysta woda, density - gęstość, temperature - temperatura
Autor: Lucinda Spokes
|
|
 |
 |
|
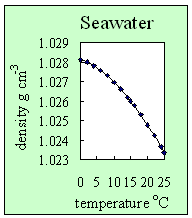
3. Zależność gęstości wody morskiej od temperatury. Przy stałej zawartości soli (tutaj: 35), gęstość wody morskiej maleje wraz ze wzrostem temperatury.
Objaśnienia: seawater - woda morska
Autor: Lucinda Spokes
|
|
 |
- Dodanie soli do wody powoduje wzrost jej gęstości. Ponadto uniemożliwia tworzenie się wiązań wodorowych. Oznacza to, że woda morska, w przeciwieństwie do czystej wody, nie osiąga największej gęstości w temperaturze 4°C, lecz gdy zamienia się w lód. Oznacza to także, że woda morska zamarza w temperaturze poniżej 0°C. Wykorzystujemy to zimą sypiąc sól na drogi aby zapobiec ich oblodzeniu.
|
- Woda ma bardzo wysoką pojemność cieplną. Oznacza to, że potrzeba bardzo dużo energii aby podnieść jej temperaturę (energia jest niezbędna dla rozerwania wiązań wodorowych). Ponieważ 71% powierzchni Ziemi pokrywa woda to dopływ energii słonecznej powoduje tylko niewielkie zmiany temperaturty Ziemi. Dzięki temu Ziemia ani się za bardzo nie przegrzewa, ani nadmiernie nie wychładza, co stwarza możliwość rozwoju organizmów żywych. W lecie ciepło jest magazynowane przez ocean, a w zimie oddawane do atmosfery. W ten sposób oceany łagodzą klimat Ziemi, zmniejszając różnice temperatury między porami roku.
|
 |
 |
 |
|
4. Aby podnieść temperaturę danej objętości wody o 1oC potrzeba cztery razy więcej energii niż w przypadku powietrza.
Autor: Lucinda Spokes
|
|
- Duża ilość energii jest także potrzebna aby zamienić wodę na parę wodną (parowanie). Jest to tzw. ciepło utajone. Gdy para wodna przemieszcza się z obszarów ciepłych ku chłodniejszym, ulega skropleniu i może utworzyć się chmura i spaść deszcz. To powoduje uwolnienie ciepła, które ogrzewa powietrze. Są to ogromne ilości energii, które powodują powstawanie sztormów i silnych wiatrów.
- Wiele substancji rozpuszcza się w wodzie i utrzymuje na stałym poziomie dzięki wiązaniom wodorowym. To pozwala na transport tlenu, dwutlenku węgla, składników odżywczych, ale także i odpadów w wodzie, oraz umożliwia wiele procesów biologicznych.
- Ponieważ cząsteczki ropy są bardzo duże i nie są naładowane elektrycznie, nie mogą ulec rozbiciu na mniejsze cząstki i nie mogą rozpuścić się w wodzie.
|
 |
 |
|
5. Pierwsze zdjęcie po lewej: statek badawczy zalewany przez fale morskie. Autor: Wendy Broadgate.
Pozostałe zdjęcia: NOAA.
|
O tej stronie:
Autor: Lucinda Spokes - Environmental Sciences, University of East Anglia, Norwich - Wielka Brytania
ostatnia aktualizacja: 2003-12-10
Tłumaczenie na język polski: Mgr Sebastian Wypych, Dr Anita Bokwa, Uniwersytet Jagielloński, Kraków
|
|
 |
|







