|
|
 |
|
|
|
 |
| |
|
|
 |
Troposfera
Wiadomości podstawowe |
Tlenki azotu - powstawanie i znaczenie
Tlenki azotu odgrywają ważną rolę w procesach atmosferycznych. W jaki sposób powstają i dlaczego mają takie znaczenie?
|
1. Ruch uliczny - ciągle znaczące źródło tlenków azotu.
(c) FreeFoto.com |
|
|
|
|
 |
Skąd biorą się tlenki azotu?
Najważniejsze tlenki azotu to tlenek azotu NO i dwutlenek azotu NO2. Oba są nazywane NOx. Cząsteczki azotu (N2) w powietrzu są bardzo trwałe i niełatwo je utlenić. Kilka rodzajów bakterii wytworzyło specjalne mechanizmy pozwalające rozbić potrójne wiązanie N-N i utworzyć tlenki. Ale o wiele ważniejsze są procesy, w których te wiązania są rozbijane przez wysoką temperaturę. Może to nastąpić tylko w warunkach ekstremalnych. Jednym z przykładów jest spalanie paliwa w silniku samochodowym. Większość antropogenicznego (czyli wynikającego z działalności człowieka) NOx pochodzi właśnie z tego źródła. Innym przykładem mogą być reakcje zachodzące w płomieniach ognia w czasie spalania biomasy. Ponadto błyskawice są ważnym, naturalnym źródłem tlenków azotu. W czasie wyładowania temperatura na torze błyskawicy sięga aż 30 000°C, tak więc wiązania azotu są łatwo rozbijane.
2. po prawej: Błyskawice są kolejnym ważnym źródłem tlenków azotu.
zdjęcie: Bernhard Mühr  Karlsruher Wolkenatlas Karlsruher Wolkenatlas
|
 |
|
 |
 |
|
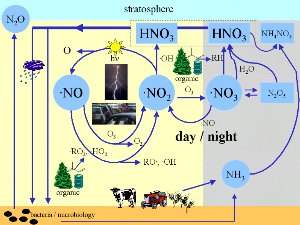
3. W jakich procesach atmosferycznych uczestniczą tlenki azotu? Schemat pokazuje niektóre ważne reakcje chemiczne zachodzące w powietrzu.
Kliknij na schemat, aby uzyskać powiększenie! (100 kB)
Autor: Elmar Uherek
Objaśnienia: day - dzień, night - noc, organic - materia organiczna, bacteria - bakterie
|
|
 |
W jakich procesach uczestniczą tlenki azotu?
NOx (= NO + NO2) i inne tlenki azotu biorą udział w bardzo wielu reakcjach chemicznych zachodzących w atmosferze. W nocy powstają rodniki azotanowe NO3, które są najaktywniejszymi utleniaczami. Rodniki są związkami chemicznymi, które są bardzo nietrwałe i zwykle reagują niezmiernie szybko.
Jeśli w zanieczyszczonym powietrzu powstaje N2O5, to może on wchodzić w reakcje z wodą, znajdującą się np. w kroplach deszczu albo na mokrych powierzchniach, w wyniku czego powstanie kwas azotowy HNO3. To właśnie HNO3 przyczynia się do powstania kwaśnego deszczu. Powstanie kwasu azotowego, który może też powstać w ciągu dnia poprzez utlenianie NO2, jest głównym sposobem usuwania tlenków azotu z atmosfery, tak wskutek suchej, jak też mokrej depozycji (wymycie przez deszcz). Kwas azotowy jest też składnikiem polarnych chmur stratosferycznych.
Trójhydrat kwasu azotowego tworzy cząsteczki, powodujące powstawanie dziury ozonowej (szczegóły w "Stratosfera - Więcej - Część 2").
|
|
Nazwy związków azotu:
|
Wzór |
Nazwa systematyczna |
Nazwa popularna |
|
NO |
monotlenek azotu |
tlenek azotu (II) |
|
N2O |
podtlenek azotu |
tlenek azotu (I), gaz rozweselający |
|
NO2 |
ditlenek azotu |
tlenek azotu (IV) |
|
NO3 |
tritlenek azotu |
tlenek azotu (VI) |
|
N2O5 |
pentatlenek diazotu |
tlenek azotu (V) |
|
N2O3 |
tritlenek diazotu |
tlenek azotu (III) |
|
HNO3 |
- |
kwas azotowy |
|
NH3 |
azan |
amoniak |
|
|
Tlenki azotu jako gazy pełnią istotną rolę w tworzeniu się i rozpadzie ozonu w troposferze, ponieważ uczestniczą one w cyklach katalitycznych. Dzieje się tak, ponieważ NO2 może ulec fotolizie pod wpływem światła słonecznego. Powstaje wtedy NO, który z powrotem utlenia się do NO2. W cyklu tym może uczestniczyć ozon, jak również organiczne rodniki nadtlenowe (nietrwałe utlenione związki chemiczne), co zostanie jeszcze szczegółowo omówione w następnym tekście.
Katalizator spalin wynaleziono głównie po to aby ograniczyć emisje tlenków azotu. Emitujemy ich zbyt dużo w procesach spalania, zwłaszcza tych zachodzących w silnikach samochodowych, przez co naruszamy równowagę w atmosferze. Podtlenek azotu NO2 powstaje na przykład dzięki bakteriom w tzw. procesach rozkładu. Procesy mikrobiologiczne związane z funkcjonowaniem tych małych organizmów odgrywają dużą rolę w obiegu azotu. Ale NO2 nie wchodzi w reakcje w troposferze. Przemieszcza się bezpośrednio do stratosfery, gdzie podlega rozpadowi pod wpływem światła słonecznego (fotoliza).
Amoniak NH3 jest najważniejszym podstawowym gazem w atmosferze. Pochodzi np. z hodowli żywca i nawożenia, a także z rozkładu mikrobiologicznego (przez bakterie). Może tworzyć cząsteczki soli NH4NO3 razem z kwasem azotowym.
|
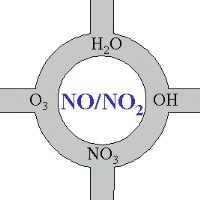
Tlenki azotu w centrum atmosferycznych procesów chemicznych
Nawet jeśli nie wiemy wszystkiego o reakcjach chemicznych zachodzących w powietrzu z udziałem tlenków azotu, to powinniśmy mieć na uwadze to, że te związki pełnią kluczową rolę w atmosferze. Większość związków chemicznych, które są utleniane i usuwane z atmosfery albo przekształcane w inne związki, wchodzi w reakcje (bezpośrednio lub pośrednio) z NO lub NO2.
|
 |
 |
 |
|
4. Tlenki azotu - w centrum atmosferycznych procesów chemicznych.
Autor: Elmar Uherek
|
|
O tej stronie:
Autor: dr Elmar Uherek - Max Planck Institute for Chemistry, Moguncja, Niemcy
Recenzent: dr Rolf von Kuhlmann, Max Planck Institute for Chemistry, Moguncja, Niemcy
Konsultacja dydaktyczna: Michael Seesing - University of Duisburg, Niemcy - 2003-07-02
Ostatnia aktualizacja: 2004-04-30
Tłumaczenie na język polski: mgr Jerzy Bojan, Zespół Szkół, Proszowice; dr Anita Bokwa, Uniwersytet Jagielloński, Kraków
|
|
 |
|







