|
|
 |
|
|
|
 |
| |
|
|
 |
Stratosfera
Dowiedz się więcej! |
Procesy chemiczne z udziałem chloru i powstawanie dziury ozonowej
To przede wszystkim procesy chemiczne z udziałem chloru powodują niszczenie warstwy ozonowej. Wraz z rozpoczęciem przemysłowej produkcji chlorofluorowęglowodorów (CFC) człowiek dostarczył do atmosfery nowe źródło chloru. Obecnie zawartość chloru w atmosferze jest sześciokrotnie większa niż to miało miejsce pierwotnie, gdy chlor pochodził tylko ze źródeł naturalnych. Ma to bardzo niekorzystne skutki dla warstwy ozonowej. Jednakże niszczenie warstwy ozonowej zachodzi w bardzo szczególnych warunkach, dlatego rzeczywiste działanie chloru jest niższe od przewidywań.
|
|
|
|
|
 |
 |
 |
|
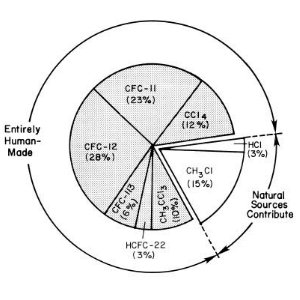
1. Źródła chloru w stratosferze na początku lat 90. XX w.
Objaśnienia: entirely human-made - substancje pochodzenia wyłącznie antropogenicznego, natural sources contribute - substancje występujące w przyrodzie
Źródło: UNEP/WMO Scientific Assessment of Ozone Depletion
|
|
 |
CFC – gazy nie występujące w przyrodzie
Gazy o największej zdolności do niszczenia warstwy ozonowej i największym wpływie na klimat to CFC-11 (CFCl3), CFC-12 (CF2Cl2) i CFC-113 (CF2ClCFCl2). Obecnie, dzięki badaniom bąbelków powietrza uwięzionym w polarnym firnie, wiadomo już, że nie ma naturalnych źródeł tych związków. Jedynym istotnym naturalnym źródłem chloru jest metylochlor CH3Cl, a okres jego przebywania w atmosferze wynosi 1,3 roku.
CFC mogą przebywać w troposferze bardzo długo, 50-100 lat, gdyż nie poddają się fotolizie ani nie wchodzą w reakcje z rodnikami OH. Docierają do stratosfery i tam ulegają fotolizie, co prowadzi do tworzenia się rodników chloru. Obecność tych rodników nie musi prowadzić do niszczenia warstwy ozonowej ponieważ zachodzą inne reakcje z ich udziałem. Aby doszło do niszczenia ozonu muszą zaistnieć pewne szczególne warunki, co pokazuje ryc. 2.
|
Warunki powstawania dziury ozonowej nad Antarktydą
W czasie nocy polarnej temperatura spada do -80°C. W stratosferze znajduje się bardzo mała ilość pary wodnej. Zamarzając tworzy ona wraz z kwasem azotowym polarne, stratosferyczne chmury lodowe (tzw. trójhydrat kwasu azotowego; ang. nitric acid trihydrate, NAT). W tej sytuacji występuje łącznie pięć kluczowych warunków:
|
|
|
 |
Drugi: na powierzchni lodowych cząstek PSC “gatunki rezerwuarowe” z nieaktywnym chlorem, czyli HCl i ClONO2 (azotan chloru), reagują między sobą i tworzy się Cl2 i HNO3; ten ostatni natychmiast jest włączany w skład cząstek.
Trzeci: po zakończeniu nocy polarnej i pojawieniu się dopływu światła słonecznego, Cl2 ulega fotolizie i tworzą się 2 rodniki Cl . Chlor staje się znowu aktywny. . Chlor staje się znowu aktywny.
|
|
|
 |
Piąty: zazwyczaj związki chloru takie jak Cl , ClO , ClO i Cl2O2 tworzą się i gromadzą raczej w górnej stratosferze, zaś ozon raczej w dolnej stratosferze. Z tego powodu kilkadziesiąt lat temu eksperci nie spodziewali się znaczącego ubytku ozonu. Ozon i substancje go niszczące powinny wchodzić w kontakt tylko w strefach granicznych. W tym miejscu pojawia się wir okołobiegunowy: związki chloru są przenoszone do niższych warstw stratosfery przez masy powietrza przemieszczające się w dół ze środkowej do dolnej stratosfery dzięki stałemu krążeniu powietrza wokół bieguna. W ten sposób związki chloru niszczące ozon są transportowane na niższe wysokości, gdzie głównie gromadzi się ozon. i Cl2O2 tworzą się i gromadzą raczej w górnej stratosferze, zaś ozon raczej w dolnej stratosferze. Z tego powodu kilkadziesiąt lat temu eksperci nie spodziewali się znaczącego ubytku ozonu. Ozon i substancje go niszczące powinny wchodzić w kontakt tylko w strefach granicznych. W tym miejscu pojawia się wir okołobiegunowy: związki chloru są przenoszone do niższych warstw stratosfery przez masy powietrza przemieszczające się w dół ze środkowej do dolnej stratosfery dzięki stałemu krążeniu powietrza wokół bieguna. W ten sposób związki chloru niszczące ozon są transportowane na niższe wysokości, gdzie głównie gromadzi się ozon.
|
Wszystkie pięć warunków musi wystąpić łącznie aby utworzyła się dziura ozonowa. Z tego powodu największe ubytki ozonu pojawiają się nad Antarktydą i tylko w czasie antarktycznej wiosny (wrzesień-październik), jak tylko promieniowanie słoneczne zaczyna tam docierać po nocy polarnej. W niektórych latach mamy porównywalne warunki nad Arktyką w marcu i mała dziura ozonowa tworzy się także nad Europą Północną. W późniejszych miesiącach chmury polarne zanikają, tlenki azotu są znów dostępne, rodniki chloru zostają usunięte i warstwa ozonowa odbudowuje się.
|
 |
 |
 |
|
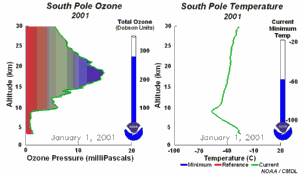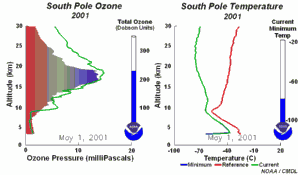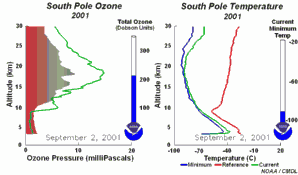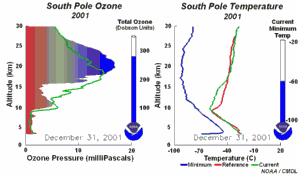
4. Rozwój dziury ozonowej w 2001 r. Lewa część animacji pokazuje na jakiej wysokości ozon nad Antarktydą jest niszczony i jak się odradza w ciągu roku. Prawa część pokazuje towarzyszące temu zmiany temperatury z wysokością.
Objaśnienia: zielona linia na lewym rysunku - zmiany zawartości ozonu (wrażonej jako ciśnienie cząstkowe ozonu w mPa) wraz z wysokością (w km) w dniu 1 stycznia 2001, zielona linia na prawym rysunku - zmiany temperatury wraz z wysokością dla poszczególnych dni, czerwona linia na prawym rysunku - zmiany temperatury wraz z wysokością w dniu 1 stycznia 2001, niebieska linia na prawym rysunku - najniższa temperatura jaka wystąpiła na poszczególnych wysokościach od 1 stycznia 2001 do danego dnia, ukazanego na animacji, total ozone (Dobson units) - całkowita zawartość ozonu w całym profilu (w dobsonach), current minimum temp. - aktualna najniższa temperatura, South Pole - biegun południowy.
Proszę kliknąć aby zobaczyć rycinę w powiększeniu oraz przebieg zjawiska co 5 dni (270 K)!
Animacja: NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado
|
|
M*: w każdej reakcji A + B -> C konieczna jest trzecia cząstka, która pochłania nadmiar energii. W przeciwnym wypadku produkt C miałby taką samą energię jak suma A + B i natychmiast nastąpiłaby reakcja odwrotna. Najczęściej M to azot z powietrza N2. |
O tej stronie:
Autor: Dr Elmar Uherek, Max Planck Insitute for Chemistry, Moguncja, Niemcy
Recenzent: Dr Christoph Brühl, Max Planck Institute for Chemistry, Moguncja, Niemcy
Konsultacja dydaktyczna: Michael Seesing - Uni Duisburg - 2003-08-07
Ostatnia aktualizacja: 2007-03-15
Tłumaczenie na język polski: Dr Anita Bokwa, Uniwersytet Jagielloński, Kraków
|
|
 |
|







