|
|
 |
|
|
|
 |
| |
|
|
 |
Stratosfera
Wiadomości podstawowe |
Skład chemiczny powietrza stratosferycznego
Większość związków chemicznych uwalnianych do atmosfery z powierzchni ziemi nie dociera do stratosfery. Są one albo niszczone przez główne utleniacze występujące w troposferze (OH, NO3, ozon), albo ulegają fotolizie wskutek działania światła słonecznego, albo opadają na powierzchnię ziemi jako wilgotny lub suchy osad lub też zostają niejako "uwięzione" w zimnej tropopauzie. Wskutek inwersji temperatury (w stratosferze panuje wyższa temperatura niż w górnej troposferze) wymiana powietrza pomiędzy troposferą a stratosferą jest powolna. Pionowa wymiana powietrza w troposferze trwa od kilku godzin do kilku dni, zaś pełne wymieszanie się stratosfery zajmuje od kilku miesięcy do kilku lat.
|
|
|
|
|
 |
Z tego powodu zawartość pary wodnej w stratosferze jest bardzo niska. Typowa zawartość to 2-6 ppm (czyli cząstek pary wodnej na milion cząsteczek powietrza) w porównaniu do 1000-40000 ppm w troposferze. W związku z tym, chmury tworzą się w stratosferze bardzo rzadko, bo potrzeba bardzo niskich temperatur aby mogły się utworzyć kryształki lodu. Takie warunki występują głównie w rejonach polarnych, gdzie mogą się tworzyć "lodowe" chmury stratosferyczne. Zawartość pary wodnej w stratosferze może się zwiększać np. na wskutek ruchu lotniczego, dlatego nie można wykluczyć, że formowanie się polarnych chmur stratosferycznych (PSC) stanie się bardziej prawdopodobne.
|
 |
 |
 |
|
1. Polarne chmury stratosferyczne nad Kiruną (Szwecja).
Źródło: MPI Heidelberg
Kliknij na rycinę aby zobaczyć ją w powiększeniu! (pełny rozmiar: 35 K)
|
|
Nieorganiczne składniki stratosfery
Skład chemiczny stratosfery jest zdominowany przez ozon, gdyż 85-90% całkowitej zawartości ozonu w atmosferze znajduje się w stratosferze. Ten gaz śladowy jest tworzony wskutek fotolizy tlenu w samej stratosferze, zaś większość innych gazów w stratosferze albo dostaje się tam z troposfery dzięki swojej trwałości (np. dwutlenek azotu NO2, metan CH4, chlorofluorowęglowodory CFC itd.) albo jest tam wynoszona przez silne erupcje wulkanów (związki siarkowe, aerozole). Składniki nieorganiczne dominują więc w składzie stratosfery, a są to: tlenki azotu, kwas azotowy, kwas siarkowy, ozon, halogeny i tlenki halogenowe z rozpadu CFC.
|
 |
 |
|
2. Erupcja wulkanu Pinatubo, Filipiny, czerwiec 2001
źródło: Cascades Volcano Observatory USGS. Fot. Rick Hoblitt
|
|
 |
Erupcje wulkanów
Silna erupcja wulkanu może dostarczyć duże ilości gazów i cząsteczek bezpośrednio do stratosfery. Do tych gazów należą kwasy halogenowe takie jak HCl i HF lub dwutlenek siarki SO2, który jest utleniany do kwasu siarkowego (H2SO4). Cząsteczki kwasu siarkowego są jednymi z najważniejszych jąder kondensacji, koniecznymi do tworzenia się chmur. Cząsteczki związków nieorganicznych znajdujące się w startosferze, głównie krzemiany, sole halogenkowe i siarczany, mogą pochłaniać światło słoneczne, co może prowadzić do tymczasowego ocieplenia w stratosferze i oziębienia w troposferze. Takie zjawiska mogą trwać około 1-2 lat i mogą być zmierzone ponad całą półkulą po takich erupcjach wulkanicznych jak wybuch Pinatubo w czerwcu 1991.
|
Co to jest stężenie (koncentracja) i stosunek zmieszania?
Zawartość danego składnika w powietrzu możemy wyrazić na dwa sposoby: podając wartość względną lub absolutną:
a) stosunek zmieszania - udział cząsteczek tej substancji w całkowitej liczbie cząsteczek powietrza. Jeśli wśród 1 miliona cząsteczek powietrza znajduje się 40 cząsteczek ozonu to stosunek zmieszania wynosi 40 ppm (ang. parts per million, czyli części milionowe). Jest to miara względna;
b) stężenie (koncentracja) - masa cząsteczek danej substancji w określonej objętości powietrza. Jeśli w jednym metrze sześciennym powietrza znajduje się 100 µg ozonu to stężenie wynosi 100 µg/m3. Jest to miara absolutna.
Ciśnienie zmniejsza się wraz ze wzrostem wysokości n.p.m., im wyżej wzniesiemy się w stratosferę, tym mniej znajdziemy cząstek powietrza w każdym metrze sześciennym jego objętości. To oznacza, że jeśli masa absolutna ozonu nie zmieni się wraz z wysokością n.p.m., to jego procentowy udział w całym powietrzu zwiększy się.
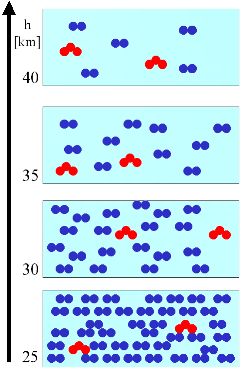
Wyjaśnimy tę ogólną zasadę na bardzo prostym przykładzie. W pewnej objętości powietrza (jasnoniebieskie pole na rysunku poniżej) jest pewna liczba cząsteczek powietrza (kolor niebieski) i pewna liczba cząsteczek ozonu (czerwone). Liczba cząsteczek powietrza zmniejsza się zawsze wraz ze wzrostem wysokości.
|
 |
 |
|
3 a. Na rysunku po lewej stronie zakładamy, że ilość cząsteczek ozonu (ich stężenie= cząsteczki/objętość = masa/objętość; jednostki to np. liczba cząsteczek/m3, hPa, μg/m3) pozostaje stała wraz ze wzrostem wysokości (czerwone trójkąty). W porównaniu do liczby cząsteczek powietrza (niebieskie kółeczka) stosunek zmieszania ozonu (zielone trójkąty) zwiększa się (jednostka to np. %, ppm, ppb, ppt). Popatrz też na rysunek poniżej.
|
|
 |
 |
 |
|
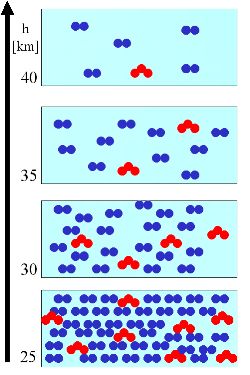
3 b. Na rysunku po prawej stronie zakładamy, że ilość cząsteczek ozonu zmniejsza się wraz ze wzrostem wysokości podobnie jak ilość cząsteczek powietrza. Stosunek zmieszania (liczba cząsteczek ozonu na cząsteczki powietrza) pozostaje stały wraz ze wzrostem wysokości (zielone trójkąty): 8/40, 4/20, 2/10, 1/5 = 20 %, ale absolutna liczba cząsteczek ozonu (czerwone trójkąty) w objętości powietrza zmniejsza się.
|
|
|
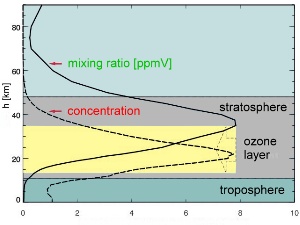
A jak jest w rzeczywistości? Przykład po prawej pokazuje warunki panujące tylko w górnych obszarach warstwy ozonowej. W części atmosfery od powierzchni ziemi do niższych warstw stratosfery panują warunki pokazane na schemacie po lewej stronie. Koncentracja pozostaje prawie taka sama, ale ponieważ otaczające powietrze staje się coraz rzadsze -stosunek zmieszania wzrasta. W niższych warstwach stratosfery nawet koncentracja wzrasta (przykład poniżej pokazuje ośmiokrotny wzrost).
|
 |
 |
|
4. Zmiany zawartości ozonu w przekroju pionowym atmosfery. Zaznaczono zarówno stężenie (concentration) jak też stosunek zmieszania (mixing ratio).
Źródło: na podstawie materiałów IUP Bremen
|
|
 |
W publikacjach możecie znaleźć różne profile zawartości ozonu w stratosferze (np. taki jak zaznaczony czerwoną linią na rysunku obok albo taki jak zaznaczony na zielono, a nawet oba naraz). Pamiętajcie jednak, że ozon to nie jedna na pięć cząsteczek w powietrzu, ale raczej jedna z miliona (1 ppm).
|
O tej stronie:
Autor: Dr Elmar Uherek, Max Planck Insitute for Chemistry, Moguncja, Niemcy
Recenzent: Dr John Crowley, Max Planck Institute for Chemistry, Moguncja, Niemcy- 2004-05-04
Konsultacja dydaktyczna: Michael Seesing - Univ. of Duisburg, Niemcy, Dr Ellen K. Henriksen - Univ. of Oslo, Norwegia, Yvonne Schleicher - Univ. of Erlangen-Nürnberg, Niemcy
Ostatnia aktualizacja: 2004-05-05
Tłumaczenie na język polski: Dr Anita Bokwa, Uniwersytet Jagielloński, Kraków |
|
 |
|







