|
|
 |
|
|
|
 |
| |
|
|
 |
Troposfera
Dowiedz się więcej! |
Utlenianie w atmosferze
Wiele związków chemicznych jest emitowane do atmosfery i gromadziłoby się tam gdyby nie były z niej usuwane. Proces ten zachodzi poprzez suchą depozycję lub poprzez wymycie z atmosfery przez deszcz (mokra depozycja). Zwłaszcza w przypadku gazowych związków organicznych usuwanie z atmosfery jest łatwiejsze jeśli najpierw zostaną one utlenione i staną się mniej lotne oraz rozpuszczalne w wodzie.
|
|
|
|
|
 |
 |
 |
|
1. OH oczyszcza powietrze
Autor: Elmar Uherek
|
|
 |
Utlenianie to nie tylko reakcje z udziałem związków zawierających tlen. Jednakże w przypadku procesów chemicznych zachodzących w powietrzu tlen bierze udział w większości z nich. Trzy główne utleniacze, które uczestniczą w większości reakcji utleniania w atmosferze to:
- rodnik hydroksylowy OH,
- rodnik azotanowy NO3,
- cząsteczka ozonu O3.
Również rodniki HO2 odgrywają ważną rolę i czasami suma OH i HO2 jest nazywana HOx. Najważniejszym utleniaczem jest jednak rodnik hydroksylowy OH. Bardzo łatwo wchodzi w reakcje chemiczne i jest w stanie utlenić większość substancji chemicznych tworzących się w troposferze.
Dlatego też OH jest nazywany "proszkiem do prania atmosfery".
|
Tylko kilka związków chemicznych, takich jak chlorofluorowęglowodory CFCs (np. CF2Cl2), podtlenek azotu N2O lub dwutlenek węgla CO2, jest bardzo trwałych i nie wchodzi w ogóle w reakcje z OH lub też reaguje bardzo wolno. Także tempo reakcji metanu (CH4) jest 100-1000 razy wolniejsze w porównaniu z innymi związkami organicznymi. To tłumaczy dlaczego stężenie metanu w atmosferze (około 1,7 ppm = 1,7 µmol/mol) może być dość wysokie, podczas gdy większość śladowych gazów organicznych osiąga stężenie poniżej 1 ppb (= 1nmol/mol)*.
|
 |
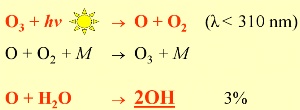 |
 |
|
2. Tworzenie się OH: >97% atomów O, utworzonych wskutek fotolizy ozonu, reaguje ponownie tworząc ozon. Tylko <3% daje początek tworzeniu się najważniejszego rodnika w atmosferze: OH
Jeśli dwie cząsteczki lub atomy A i B zderzają się i tworzą cząsteczkę C, to konieczna jest dodatkowa cząstka M aby przejąć nadmiar energii. Ta cząstka (zazwyczaj azot N2) sam nie wchodzi w reakcje.
|
|
 |
 |
|
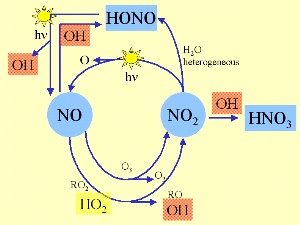
3. Cykle powstawania i rozpadu OH i tlenku azotu
Autor: Elmar Uherek
Proszę kliknąć na rycinę aby zobaczyć ją w powiększeniu! (90 K)
|
|
 |
Jak się tworzy OH?
OH pełni decydującą rolę w procesach chemicznych w atmosferze w ciągu dnia, ponieważ jego powstawanie zależy przede wszystkim od natężenia obecności promieniowania słonecznego. Reakcja początkowa (ryc. 2) to rozbicie ozonu przez promieniowanie słoneczne (fotoliza), które zachodzi przy długości fali poniżej 310 nm. Następnie utworzony atom tlenu O reaguje z wodą. Z tego powodu obecność niewielkich ilości ozonu w troposferze jest bardzo ważna dla reakcji chemicznych w niej zachodzących, choć nadmiar ozonu troposferycznego jest bardzo niezdrowy dla organizmów żywych.
Inne źródła OH to fotoliza kwasu azotawego HONO, nadtlenku wodoru H2O2 i peroksymetanu CH3OOH, reakcja NO z rodnikiem HO2 lub reakcja alkenów z ozonem. Ryc. 3 pokazuje w jaki sposób OH jest związane z cyklem reakcji tlenków azotu w ciągu dnia.
|
Ile OH powstaje w atmosferze?
OH jest bardzo aktywnym chemicznie rodnikiem i dlatego wchodzi w reakcje chemiczne najdalej sekundę po powstaniu. Oznacza to, że jego stężenie jest bardzo niskie, od 1x105 do 2x107 cząsteczek cm-3. Przy ciśnieniu standardowym (na poziomie morza) daje to stosunek zmieszania równy 0,01 - 1 ppt (pmol/mol).
Tworzenie się OH zależy od dostępności pary wodnej, dlatego też jego stężenie spada wraz z wysokością n.p.m. (czym wyżej tym powietrze jest chłodniejsze i suchsze).
|
 |
 |
 |
|
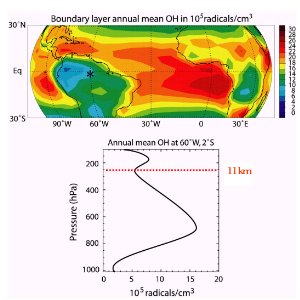
4. Rozkład przestrzenny OH
Ciśnienie 250 hPa występuje zazwyczaj na wysokości 11 km (co odpowiada tropopauzie w szerokościach umiarkowanych). Jakim wysokościom odpowiadają wartości 1000, 800, 600 i 400 hPa? Użyj diagramu prezentującego zależność ciśnienia od wysokości!
Źródło: prezentacja J. Lelievelda - MPI Moguncja, Niemcy, 2003 r.
Proszę kliknąć na rycinę aby zobaczyć ją w powiększeniu ! (80 K)
|
|
Szczególnie jednak maleje wraz ze wzrostem szerokości geograficznej ponieważ wiąże się z tym nie tylko spadek zawartości pary wodnej w powietrzu, ale także spadek natężenia i czasu trwania promieniowania słonecznego.
W jakich reakcjach uczestniczy OH?
Ryc. 5 pokazuje ciekawe zjawisko obserwowane ponad wilgotnymi lasami tropikalnymi. Stężenie OH spada przy powierzchni ziemi. Dlaczego? Wiele związków organicznych, przede wszystkim izopren, jest emitowane przez lasy i reaguje z OH. Dlatego zachodzi tam silne usuwanie OH przy powierzchni ziemi, jest zużywane w reakcjach chemicznych. OH ma silną tendencję do odrywania atomu wodoru z organicznych związków RH kiedy to jest tylko możliwe, i następnie tworzenia wody H2O. Z kolei rodnik R reaguje z tlenem O2 i tworzy organiczne nadtlenki, które są konieczne np. do prawidłowego przebiegu cyklu tworzenia się ozonu. reaguje z tlenem O2 i tworzy organiczne nadtlenki, które są konieczne np. do prawidłowego przebiegu cyklu tworzenia się ozonu.
|
 |
 |
 |
|
5. Rozkład przestrzenny OH w regionach międzyzwrotnikowych
na górze: całkowite stężenie w regionach międzyzwrotnikowych
na dole: profil stężenia nad Manaus (Brazylia), stacja w lesie wilgotnym
Źródło: prezentacja J. Lelievelda, MPI Moguncja, Niemcy, 2003 r.
Proszę kliknąć na rycinę aby zobaczyć ją w powiększeniu! (80 K)
|
|
|
Występujący na całym świecie OH nie reaguje jednak głównie ze związkami organicznymi dostarczanymi przez lasy. Gazy organiczne odpowiadają w 30% za usuwanie OH z atmosfery, ponadto następne 15% przypada na metan, najważniejszą i najmniejszą cząstkę organiczną. Gazem, który odpowiada za 40% reakcji z OH jest tlenek węgla, a pozostałe 15% przypada na ozon O3, rodnik HO2 i wodór H2. |
 |
 |
|
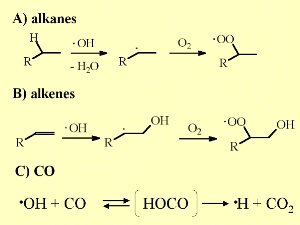
6. Ważne reakcje z udziałem OH w atmosferze
Proszę kliknąć na rycinę aby zobaczyć ją w powiększeniu! (45 K)
|
|
 |
Reagując z niewielkimi alkenami, szczególnym rodzajem związków organicznych, OH ma tendencję aby łączyć się z podwójnym wiązaniem tak długo jak nasycona reszta nie jest dużo większa, a odrywanie H jest statystycznie częste. Także w tym przypadku następuje tworzenie się nadtlenków.
OH może utleniać tlenek węgla CO do dwutlenku węgla CO2. Jak już widzieliśmy, CO i metan CH4 są głównymi substancjami zużywającymi OH. Inne aktywne chemicznie związki organiczne są dostępne tylko w śladowych ilościach (rzędu ppt), podczas gdy CO osiąga średnio poziom 120 ppb na półkuli północnej (większe natężenie procesów spalania paliw kopalnych) i 60 ppb na półkuli południowej.
|
Chociaż OH jest najważniejszym utleniaczem w atmosferze, to jego stężenie w nocy jest bliskie zeru ponieważ brak promieniowania słonecznego, niezbędnego do jego tworzenia się. Z tego powodu w nocy i w okresach niedoboru światła slonecznego procesy chemiczne z udziałem azotanów NO3 i ozonu O3 stają się ważniejsze
|
 |
 |
 |
|
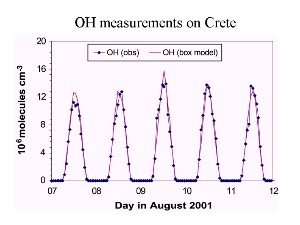
7. Zmiany stężenia OH w czasie pomiarów na Krecie w sierpniu 2001 r.
Źródło: prezentacja J. Lelievelda, MPI Mainz, 2003 r.
|
|
* Stosunek zmieszania wyrażony w ppb lub ppm (= 1 cząsteczka na 1 miliard cząsteczek, lub 1 cząsteczka na 1 milion cząsteczek) jest miarą często używaną w publikacjach naukowych. Używamy go także w naszej encyklopedii. Jednakże bardziej poprawnie jest używać jednostki 1 nmol/mol (= 1 ppb) lub 1 µmol/mol (= 1 ppm), ponieważ ilość cząsteczek n jest mierzona w jednostce mol.
|
O tej stronie:
Autor: dr Elmar Uherek - Max Planck Institute for Chemistry, Moguncja, Niemcy
Recenzent: Dr. Mark Lawrence - Max Planck Institute for Chemistry, Moguncja, Niemcy - 2004-05-05
Konsultacja dydaktyczna: Michael Seesing - Uni Duisburg - 2003-07-02
Ostatnia aktualizacja: 2004-05-07
Tłumaczenie na język polski: dr Anita Bokwa, Uniwersytet Jagielloński, Kraków
|
|
 |
|







