|
|
 |
|
|
|
 |
| |
|
|
 |
Klimat miasta
Dowiedz się więcej! |
1. Zanieczyszczenie powietrza
Ćwiczenie 2
Ozon w miastach i ich otoczeniu
|
|
|
|
|
 |
Eksperyment: wytwarzanie ozonu i analiza ilościowa
(UWAGA: Niektóre substancje i promieniowanie UV używane w tym eksperymencie są szkodliwe. Zapoznaj się z właściwościami tych substancji zanim zaczniesz eksperyment. Zachowaj ostrożność!
W reaktorze z lampą chłodzoną wodą przez 20 minut są naświetlane: atmosfera z tlenem, 40 ml roztworu jodku potasu (w=10%), 10 ml kwasu siarkowego (c=0,025 mol/l) i kilka kropli roztworu skrobi. Roztwór należy energicznie mieszać w czasie naświetlania. 20 ml roztworu, które zmieniło kolor na niebieski w czasie naświetlania należy najpierw zmiareczkować roztworem siarczanu sodu (c=0,001 mol/l) aż stanie się bezbarwne. Dodaj błękitu bromotymolowego i znowu miareczkuj, tym razem z roztworem węglowodoru sodu (c=0,005 mol/l), aż ponownie pojawi się kolor niebieski. W dalszych seriach pomiarowych powinieneś dodawać różne gazy (metan, NO2). Rezultaty eksperymentu powinny być następujące:
|
 |
 |
 |
|
Ryc. 1 Przygotowanie eksperymentu
© Tausch, von Wachtendonk: Chemie 2000+; Buchner Verlag, Bamberg 2001
|
|
|
atmosfera |
O2 |
O2 +
CCl2F2 |
O2 +
NO2 |
O2 +
NO2 +
CH4 |
O2 +
CH4 |
O2 + NO2
eksperyment bez naświetlania) |
|
określenie zawartości jodu: VS(Na2S2O3) = |
46,0 ml |
104,0 ml |
94,4 ml |
78,4 ml |
72,0 ml |
112,0 ml |
|
określenie zawartości kwasu
VS(NaOH) = |
31,4 ml |
37,1 ml |
30,6 ml |
27,2 ml |
32,3 ml |
39,5 ml |
|
Z 1 |
Na podstawie wyników pomiarów oblicz odpowiadające im ilości ozonu w molach (na osobnej kartce papieru) i wypełnij tabelę poniżej.
(Jesli potrzebna Ci pomoc możesz porównac swoje obliczenia z modelowym obliczeniem dla atmosfery zawierającej tlen . Kliknij na link.) |
|
atmosfera |
O2 |
O2 +
CCl2F2 |
O2 +
NO2 |
O2 +
NO2 +
CH4 |
O2 +
CH4 |
O2 + NO2
eksperyment bez naświetlania |
|
określenie zawartości jodu:
n(O3) w 10-5mol |
5,75 |
|
|
|
|
|
|
określenie zawartości kwasu
n(O3) w 10-5mol |
5,40 |
|
|
|
|
|
Dwie reakcje mają miejsce wewnątrz reaktora (reakcja (2) zachodzi pod koniec fazy): |
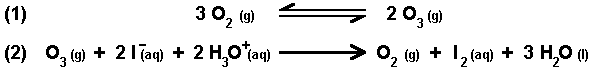 |
 |
|
|
|
|
Z 2 |
Ozon słabo się rozpuszcza w wodzie. Patrząc na opisane reakcje wyjaśnij dlaczego w czasie eksperymentu trzeba energicznie mieszać naczyniem. |
|
Z 3 |
Dodaj wartości obliczone w Z1 do diagramu poniżej. |
|
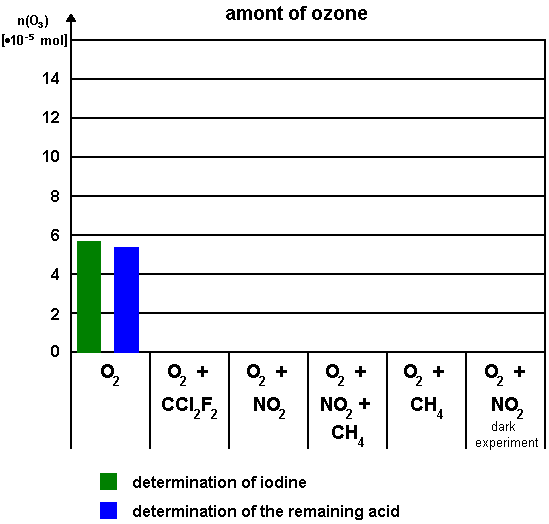 |
 |
|
Objaśnienia: amount of ozone - ilość ozonu, determination of iodine - określenie zawartości jodu, determination of the remaining acid - określenie zawartości pozostałego kwasu, dark experiment - eksperyment bez naświetlania
|
|
|
Z 4 |
Czego się nauczyłeś porównując różne wyniki? |
|
|
Z5 |
Na ryc. 2 przedstawiono względne stężenia zanieczyszczeń powietrza w czasie letniego dnia.
Wyjaśnij dlaczego dlaczego stężenia są wysokie rano, oraz dlaczego węglowodory i tlenki azotu powodują powstawanie ozonu w miastach i terenach je otaczających. |
|
 |
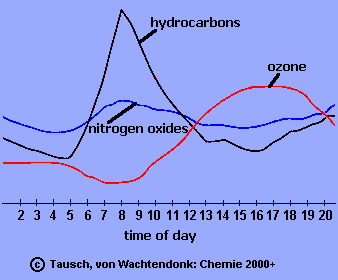 |
 |
|
Ryc. 2. Zmiany stężenia zanieczyszczeń powietrza w ciągu dnia latem.
Objaśnienia: time of day - godziny w ciągu dnia, hydrocarbons - węglowodory, ozone - ozon, nitrogen oxides - tlenki azotu
|
|
|
|
Z6 |
Jeśli przeprowadzisz wykrycie obecności ozonu przy pomocy dymu papierosowego w ten sam sposób jak z jodem to otrzymasz podobny wynik. Czy z tego wynika, że w dymie papierosów jest ozon? (patrz eksperyment bez naświetlania z Z1.) |
|
O tej stronie:
Autorzy: M. Seesing, M. Tausch - Universität Duisburg-Essen, Duisburg / Niemcy
ostatnia aktualizacja: 2004-05-24
Tłumaczenie na język polski: dr Anita Bokwa, Uniwersytet Jagielloński, Kraków
|
|
 |
|







