|
|
 |
|
|
|
 |
| |
|
|
 |
Stratosfera
Wiadomości podstawowe |
Chlorofluorowęglowodory (CFC) i dziura ozonowa
Historia powstawania dziury ozonowej jest dobrym przykładem na to jak pozornie nieszkodliwa grupa związków chemicznych może stać się prawdziwym zagrożeniem dla życia na Ziemi, a także na to jak rządy państw, przedstawiciele sektora przemysłowego i obywatele mogą współpracować aby zbadać i rozwiązać ten problem.
|
|
|
|
|
 |
|
Każda zmiana wywołana przez człowieka w systemie klimatycznym może zakłócić naturalną równowagę ziemskiego ekosystemu w sposób trudny do przewidzenia. Jeśli jednak społeczność międzynarodowa będzie umiała odpowiednio pokierować swoimi działaniami to globalne problemy środowiskowe będzie można rozwiązać.
Freony (CFC) to tylko jedna z grup substancji, które niszczą warstwę ozonową, ale za to najważniejsza.
|
Wykorzystanie i właściwości CFC
Chlorofluorowęglowodory to związki takie jak np. CFCl3 lub CF2Cl2 (potocznie nazywane są freonami, choć to nazwa handlowa, nie chemiczna). CFC są używane w wielu procesach przemysłowych i w wielu produktach, jako substancja chłodząca, rozpuszczalnik w przemyśle elektronicznym, środek pieniący, rozpylający. Freony można znaleźć w gaśnicach, środkach do czyszczenia na sucho, środkach do usuwania tłuszczu, materiałach izolacyjnych (w tym budowlanych) i styropianie.
Powodem takiej ich popularności jest to, że nie wpływają one w żaden sposób na ludzkie zdrowie. Gazy te nie wchodzą w żadne reakcje ani ze składnikami atmosfery, ani z substancjami budującymi nasze ciało. Z tego powodu czas ich trwania w atmosferze jest bardzo długi i mogą się w niej gromadzić. Szkodliwą właściwością tych gazów, której nie wzięto pod uwagę, jest to, że ulegają one fotolizie pod wpływem promieni UV dochodzących ze Słońca.
|
 |
 |
 |
|
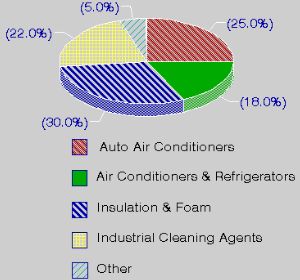
1. Wykorzystanie CFC
Objaśnienia: auto air conditioners – klimatyzacja w samochodach, air conditioners and refrigerators- klimatyzacja pomieszczeń i lodówki, insulation and foam – materiały izolacyjne i styropian, industrial cleaning agents – przemysłowe środki czyszczące, other - inne
Źródło: US Environmental Protection Agency (EPA)
|
|
 |
 |
|
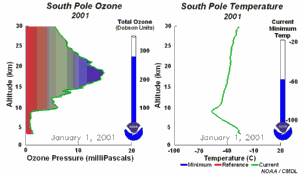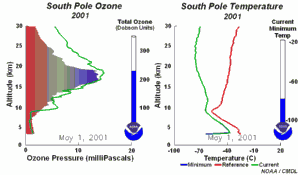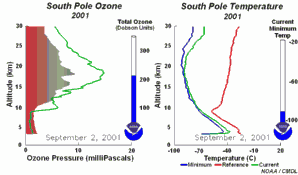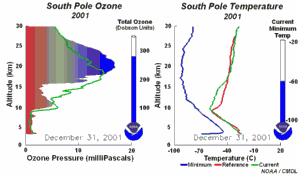
2. Rozwój dziury ozonowej w 2001 r. Lewa część animacji pokazuje na jakiej wysokości ozon nad Antarktydą jest niszczony i jak się odradza w ciągu roku. Prawa część pokazuje towarzyszące temu zmiany temperatury z wysokością.
Objaśnienia: zielona linia na lewym rysunku - zmiany zawartości ozonu (wrażonej jako ciśnienie cząstkowe ozonu w mPa) wraz z wysokością (w km) w dniu 1 stycznia 2001, zielona linia na prawym rysunku - zmiany temperatury wraz z wysokością dla poszczególnych dni, czerwona linia na prawym rysunku - zmiany temperatury wraz z wysokością w dniu 1 stycznia 2001, niebieska linia na prawym rysunku - najniższa temperatura jaka wystąpiła na poszczególnych wysokościach od 1 stycznia 2001 do danego dnia, ukazanego na animacji, total ozone (Dobson units) - całkowita zawartość ozonu w całym profilu (w dobsonach), current minimum temp. - aktualna najniższa temperatura, South Pole - biegun południowy.
Proszę kliknąć aby zobaczyć rycinę w powiększeniu oraz przebieg zjawiska co 5 dni (270 K)!
Animacja: NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado
|
|
 |
Przemiany CFC w stratosferze
Silne promieniowanie ultrafioletowe UV-B docierające ze Słońca jest zatrzymywane przez warstwę ozonową w stratosferze, dlatego też ta część UV, która dociera do powierzchni ziemi jest zbyt słaba aby w istotny sposób powodować niszczenie CFC. Proces ten jednak rozpoczął się z chwilą, gdy CFC stopniowo dostały się do stratosfery. Rozpad CFC prowadzi do powstawania rodników chloru i fluoru. Nie oznacza to jednak, że natychmiast następuje silne niszczenie warstwy ozonowej, gdyż związki chloru, które są główną przyczyną niszczenia warstwy ozonowej, wchodzą także w inne reakcje, zależnie od warunków pogodowych. Chociaż ozon stratosferyczny jest niszczony w różnych szerokościach geograficznych, to dziura ozonowa tworzy się tylko nad obszarami polarnymi, w szczególności nad Antarktydą i tylko wiosną. Co jest tego przyczyną?
|
Reakcje chemiczne
Ozon tworzący warstwę ozonową jest w stanie równowagi; tworzy się i jest niszczony pod wpływem promieniowania UV. Rodniki chloru (Cl ) są katalizatorami, które biorąc udział w całym łańcuchu reakcji chemicznych doprowadzają do niszczenia ozonu. Są w tym bardzo wydajne ponieważ podczas tych reakcji nie ulegają zużyciu, lecz cyklicznie powracają. ) są katalizatorami, które biorąc udział w całym łańcuchu reakcji chemicznych doprowadzają do niszczenia ozonu. Są w tym bardzo wydajne ponieważ podczas tych reakcji nie ulegają zużyciu, lecz cyklicznie powracają.
|
 |
 |
 |
|
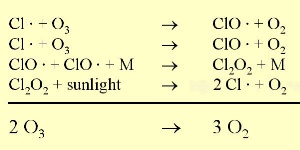
3. Reakcje chloru i ozonu. Kropki oznaczają rodniki.
Objaśnienia: sunlight - światło słoneczne
Proszę kliknąć na rycinę aby zobaczyć ją w powiększeniu! (35 K)
|
|
Warunki pogodowe
Rozpad CFC prowadzi w kolejnych reakcjach do powstania rodników ClO , które reagują z dwutlenkiem azotu (NO2) i tworzą ClONO2. W przypadku reakcji z tlenkiem azotu (NO) i metanem tworzy się HCl, a z reakcji ClONO2 z HCl powstaje także kwas azotowy (HNO3). Nie będziemy omawiać wszystkich reakcji chemicznych szczegółowo, ale warto wiedzieć, że oba produkty (HCl i ClONO2) nie wchodzą w reakcje chemiczne z ozonem i są raczej stabilnymi związkami. Tylko w pewnych warunkach pogodowych powstają substancje, które ostatecznie niszczą warstwę ozonową. Około trzy lata intensywnych badań na brytyjskiej stacji badawczej Halley Bey na Antarktydzie, podjętych po odkryciu dziury ozonowej w 1985 r., pozwoliło zrozumieć te skomplikowane zależności. , które reagują z dwutlenkiem azotu (NO2) i tworzą ClONO2. W przypadku reakcji z tlenkiem azotu (NO) i metanem tworzy się HCl, a z reakcji ClONO2 z HCl powstaje także kwas azotowy (HNO3). Nie będziemy omawiać wszystkich reakcji chemicznych szczegółowo, ale warto wiedzieć, że oba produkty (HCl i ClONO2) nie wchodzą w reakcje chemiczne z ozonem i są raczej stabilnymi związkami. Tylko w pewnych warunkach pogodowych powstają substancje, które ostatecznie niszczą warstwę ozonową. Około trzy lata intensywnych badań na brytyjskiej stacji badawczej Halley Bey na Antarktydzie, podjętych po odkryciu dziury ozonowej w 1985 r., pozwoliło zrozumieć te skomplikowane zależności.
|
 |
 |
|
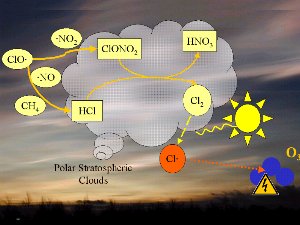
4. Reakcje chemiczne zachodzące w polarnych chmurach stratosferycznych prowadzą do tworzenia się groźnych rodników chloru Cl (na czerwono).
Proszę kliknąć na rycinę aby zobaczyć ją w powiększeniu (100 K)!
|
|
 |
1) Jednym z czynników jest niezwykle niska temperatura panująca w stratosferze, około -80°C lub nawet mniej, nad Antarktydą, w czasie nocy polarnej. W takich warunkach kwas azotowy i woda tworzą lodowe chmury stratosferyczne, które nie są w stanie przetrwać zbyt długo przy wyższych temperaturach. Na powierzchni tych chmur lodowych HCl i ClONO2 reagują ze sobą i tworzą kwas azotowy i czysty chlor Cl2.
2) Chlor Cl2 jest stabilny, nie reaguje z ozonem, ale łatwo ulega fotolizie pod wpływem promieni słonecznych i tworzy 2 rodniki Cl , które atakują ozon (pomarańczowa strzałka na ryc. 4). , które atakują ozon (pomarańczowa strzałka na ryc. 4).
|
 |
 |
|
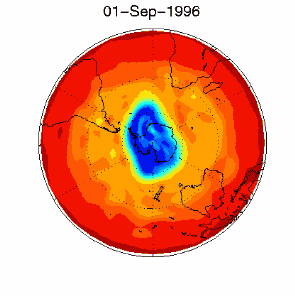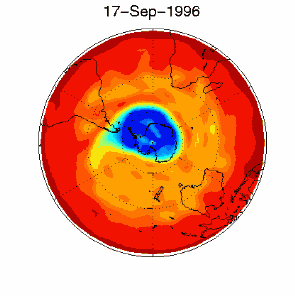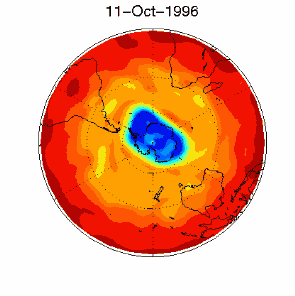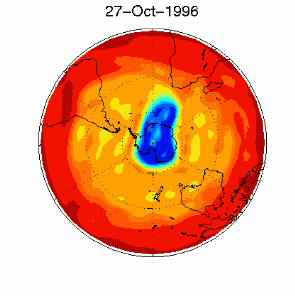
6. Dziura ozonowa w obszarze objętym dryfem wiatrów zachodnich nad Antarktydą 1 września 1996 r.
Źródło: baza danych UKMO, opublikowane przez Brown University
Proszę kliknąć na rycinę aby zobaczyć ją w powiększeniu (330 K)!
|
|
 |
3) Ostatecznie cały proces nie powinien przebiegać zbyt gwałtownie i nie powinien szkodzić tej części polarnej warstwy ozonowej, w której występuje najwyższe stężenie ozonu (wysokość 14-22 km), ponieważ związek źródłowy ClO tworzy się zwykle na wyższych wysokościach. Aby ClO tworzy się zwykle na wyższych wysokościach. Aby ClO mogły dotrzeć do niższych warstw stratosfery musi istnieć mechanizm ich przenoszenia. Ma to miejsce tylko w tzw. wirze okołobiegunowym. Panują tu specyficzne warunki meteorologiczne związane z wielkoskalowym krążeniem powietrza wokół bieguna południowego. mogły dotrzeć do niższych warstw stratosfery musi istnieć mechanizm ich przenoszenia. Ma to miejsce tylko w tzw. wirze okołobiegunowym. Panują tu specyficzne warunki meteorologiczne związane z wielkoskalowym krążeniem powietrza wokół bieguna południowego.
Jak widzimy, warunki do tworzenia się dziury ozonowej (niskie temperatury w czasie nocy polarnej, tworzenie się chmur lodowych, wir okołobiegunowy) są tak szczególne, że proces ten prawdopodobnie nigdy nie zostałby objaśniony czy choćby przewidziany przez naukowców, gdyby nie jego rzeczywiste obserwacje.
|
Przyszłość dziury ozonowej
CFC są obecnie substancjami zabronionymi na świecie (dzięki protokołowi montrealskiemu dotyczącemu substancji niszczących ozon z 1987 wraz z późniejszymi poprawkami). Wskutek ich trwałości zajmie następne 50 lat zanim CFC dotychczas wprowadzone do atmosfery zostaną z niej usunięte a poziom zawartości ozonu stratosferycznego ustabilizuje się. Naukowcy uważają, że w roku 2000 dziura ozonowa osiągnęła swoje maksymalne rozmiary, gdyż w ciągu ostatnich kilku lat nie ulegały one znacznym zmianom. Jednakże od każdej reguły zdarzają się wyjątki. W roku 2002 wcale nie obserwowano znaczących ubytków ozonu. Powód był prosty: było zbyt ciepło i wir okołobiegunowy nie miał takiego zasięgu jak zwykle. Jeszcze raz przekonaliśmy się, że procesy atmosferyczne czasem wymykają się przewidywaniom. Natomiast w roku 2003 dziura ozonowa znowu dała o sobie znać, przyjmując poprzednie rozmiary, a nawet osiągając drugą co do wielkości notowaną wielkość.
|
 |
 |
 |
|
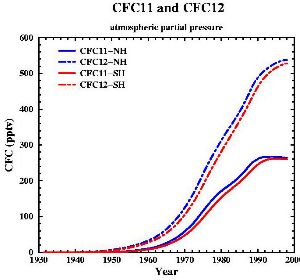
7. Zmiany zawartości w powietrzu dwóch najważniejszych rodzajów CFC (nazywanych także FREON 11 i FREON 12).
Źródło danych: Walker i in., J. Geophys. Res., 105, 14,285-14,296, 2000 [rys. w internecie]; diagram: Gian-Kasper Plattner (Univ. of Bern, UCLA)
|
|
O tej stronie:
Autor: Dr Elmar Uherek, Max Planck Insitute for Chemistry, Moguncja, Niemcy
1. Recenzent: Dr Rajendra Shende, Head Energy and Ozone Action, United Nations Environment Programme 2003-10-06
2. Recenzent: Dr John Crowley - Max Planck Institute for Chemistry, Moguncja, Niemcy 2004-05-06
Konsultacja dydaktyczna: Hendrik Förster i jego uczniowie, Gimnazjum Nordpfalz Kirchheim-Bolanden - marzec 2004 r.
Ostatnia aktualizacja: 2007-03-15
Tłumaczenie na język polski: Dr Anita Bokwa, Uniwersytet Jagielloński, Kraków
|
Polecane strony internetowe:
|
|
 |
|







