|
|
 |
|
|
|
 |
| |
|
|
 |
Klimat miasta
Wiadomości podstawowe |
Co to są kwaśne deszcze?
Woda jest niezbędna do życia na Ziemi. Kiedy staje się zanieczyszczona to ma to wpływ na całe środowisko przyrodnicze. Kwaśne deszcze są powodowane przede wszystkim przez antropogeniczne emisje zanieczyszczeń powietrza, wskutek spalania paliw kopalnych. Kwasowość opadu można zmierzyć używając skali pH.
|
|
|
|
|
 |
|
Opad atmosferyczny (deszcz, śnieg, mżawka itp.) spływa do rzek, wsiąka w glebę lub paruje i staje się parą wodną w powietrzu. Ważną cechą opisującą jakość wody jest wskaźnik pH.
|
 |
 |
|
1. Skala pH. Typowe pH niektórych produktów spożywczych i stężonych roztworów wodnych środków czystości używanych w gospodarstwie domowym. Czym niższa wartość, tym większa kwasowość.
Autor: Sebastian Wypych
|
|
 |
Skala pH
W przyrodzie występuje wiele substancji, które rozpuszczają sie w wodzie i nadają powstałym roztworom określone pH. Czym bardziej kwasowy roztwór, tym pH niższe.
pH to ujemny logarytm dziesiętny stężenia jonów hydroniowych, wyrażonych w molach na decymetr sześcienny:
pH = -log10[H3O+]
Jeśli stężenie jonów hydroniowych c(H3O+) = 10-7mol/l, to pH wynosi 7, jeśli 10-6 mol/l, to pH wynosi 6 itd.
Ta skala została wynaleziona przez duńskiego naukowca Sorena Sorensena w 1909 r. Oryginalnie pH zostało zdefiniowane jako minus logarytm ze stężenia jonów wodorowych (H+). Późniejsze badania wykazały jednak, że wolne jony wodorowe (wolny proton) nigdy nie występują w roztworach wodnych, gdyż są natychmiast solwatowane wg równania:
H+ + H2O -> H3O+
Skala pH ma zakres od 0 do 14, gdzie wartość 7 oznacza warunki neutralne. Wartości wyższe niż 7 oznaczają roztwór zasadowy, a poniżej 7 - kwasowy. Dla przykładu ocet winny ma pH 2,5-3, woda destylowana 7,0, stężony roztwór wodny sody spożywczej (NaHCO3(aq)) 8,2, niektóre środki czyszczące zawierające wodorotlenek amonowy (NH4OH(aq)) 11-12, a wapno gaszone (Ca(OH)2(aq)) 12,4.
W czystej (destylowanej) wodzie cząsteczki wody (H2O) ulegają samorzutnej autodysocjacji co prowadzi do powstawania jonów H3O+ i OH-:
H2O + H2O - >< - H3O+ + OH-
Reakcja ta jest odwracalna. Powoduje, że stężenie jonów H3O+ w wodzie destylowanej w temp. 20°C wynosi dokładnie 10-7 mol/l, dlatego pH wody destylowanej wynosi 7.
|
|
Kwaśne deszcze
Opad atmosferyczny jest zazwyczaj nieco kwaśny, gdyż dwutlenek węgla (CO2), występujący w sposób naturalny w powietrzu, rozpuszcza się w opadzie, tworząc roztwór kwasu węglowego (H2CO3), co obniża pH do 5,6. Dzieje się tak ponieważ kwas węglowy jest nietrwały i dysocjuje w wodzie tworząc jony hydroniowe i wodorowęglanowe:
|
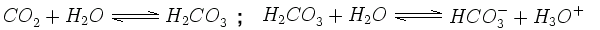 |
 |
|
W bardziej zasadowych roztworach, o wyższym pH, wodorowęglan może utracić jon wodorowy i stać się węglanem. Wiele skał i osadów, np. wapień czy dolomit składają się z soli węglanowych.
|
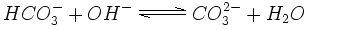 |
 |
|
|
|
Nie zanieczyszczony opad atmosferyczny jest nieco kwasowy z powodu zawartości kwasu węglowego. O kwaśnych deszczach mówimy jednak dopiero wtedy kiedy pH opadu jest poniżej 5,6. Niektórzy naukowcy za kwaśny deszcz uznają jednak opad, którego pH jest poniżej 5,0. Oprócz kwaśnego deszczu może też wystąpić kwaśny śnieg czy kwaśna mgła, więc ogólnie możemy mówić o kwaśnych opadach. Udział ludzi w powstawaniu kwaśnych deszczy wiąże się z emisją związków azotu i siarki.
SO2 i NOx biorą udział w wielu skomplikowanych reakcjach chemicznych zanim staną się kwasem siarkowym (H2SO4) i azotowym (HNO3), zakwaszającymi opady.
|
 |
Kwas siarkowy tworzy się ze związków siarki:
dwutlenek siarki i tlen reagują dając trójtlenek siarki:
2SO2 +O2 -> 2SO3
trójtlenek siarki i woda reagują dając kwas siarkowy:
SO3 + H2O -> H2SO4
Kwas azotowy powstaje z tlenków azotu:
dwutlenek azotu i woda reagują dając kwas azotowy i kwas azotawy (czyli kwas azotowy (III)):
2NO2 + H2O -> HNO3 + HNO2 |
|
pH kwaśnej chmury może wynosić zaledwie 2,6. W obszarach uprzemysłowionych kwaśny deszcz ma zwykle pH około 4,0. Mgły w Los Angeles często mają pH poniżej 3,0. W pewnych regionach świata to związki organiczne emitowane przez rośliny powodują zakwaszenie opadów, np. w pn. Australii pH opadów moze z tego powodu wynosić zaledwie 4,4.
|
|
Przyczyna: emisje SO2 i NOx
Co zakwasza opad? Kwasy występujące w atmosferze powstają głównie wskutek reakcji chemicznych między gazami SO2 i NOx i wodą. Większość SO2 i NOx jest emitowana do atmosfery wskutek spalania paliw kopalnych. Transport drogowy, morski i lotniczy jest znaczącym źródłem emisji NOx; źródła naturalne to wybuchy wulkanów, pioruny i rozkład materii organicznej. Naturalne źródła SO2 to wybuchy wulkanów, oceany (siarczek metylu), rozkład materii organicznej i pożary lasów. Kwaśne deszcze to jednak głównie skutek emisji antropogenicznych.
|
Wątpliwości i niepewności związane z globalnymi emisjami
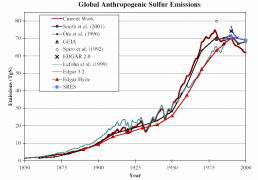
Poważne wątpliwości i niepewności są związane z zestawieniem globalnych emisji SO2 i NOx. Naturalne emisje SO2 są szacowane na 25 do 50% całkowitej globalnej emisji. Jednakże w obszarach uprzemysłowionych i zurbanizowanych źródła antropogeniczne dostarczają aż 90% SO2 i NOx. Stopień niepewności jest różny dla poszczególnych regionów. Jest to spowodowane niewystarczającą ilością danych o emisjach, zwłaszcza z działalności rolniczej, a także słabym rozpoznaniem przemieszczania się zanieczyszczeń w tzw. źródłach rozproszonych, np. glebach czy wodach. Rycina 3 pokazuje wyniki różnych badań. Proszę zauważyć, że na ryc. 3 i 4 wartości dotyczą czystej siarki, zaś na ryc. 2 - SO2.
|
 |
 |
 |
|
3. Zmiany globalnych antropogenicznych emisji siarki. Rycina prezentuje wyniki uzyskane przez różnych autorów.
Objaśnienia: year - rok, TgS - teragramy siarki, 1 Tg = 1012 g = 1 Mt (megatona) =106 ton = mln ton
Źródło: S. J. Smith, R. Andres, E. Conception, J. Lurz, 2004, Sulfur dioxide emissions: 1850-2000 (JGCRI Report. PNNL-14537)
Proszę kliknąć na rycinę, aby zobaczyć ją w powiększeniu! (26 K)
|
|
|
Zmiany wielkości emisji
Działalność człowieka spowodowała dwukrotne zwiększenie naturalnego wiązania azotu, a depozycja wzrosła od 3 do ponad 10 razy, w porównaniu z okresem przed-przemysłowym. Emisje siarki do atmosfery także się podwoiły.
|
 |
 |
|
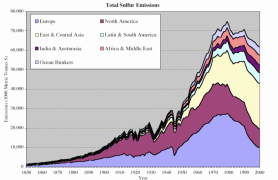
4. Udział głównych regionów ekonomicznych świata w antropogenicznych emisjach siarki od roku 1850.
Źródło: S. J. Smith, R. Andres, E. Conception, J. Lurz, 2004, Sulfur dioxide emissions: 1850-2000 (JGCRI Report. PNNL-14537)
Objaśnienia: Austurasia - Australia, Nowa Zelandia, Pd.-Wsch. Azja, Ocean Bunkers - paliwa używane jako napęd dla statków dalekomorskich, Europe - Europa, East and Central Asia - Azja wsch. i środk., North America - Ameryka Pn., Latin and South America - Ameryka Łacińska i Pd., Africa and Middle East - Afryka i Środkowy Wschód, year - rok, emissions - emisje (w tys. ton siarki)
Kliknij na rycinę, aby zobaczyć ją w powiększeniu! (66 K)
|
|
 |
Od czasów rewolucji przemysłowej Europa i Ameryka Pn. przodują w antropogenicznych dostawach siarki do atmosfery. Jednak za globalny wzrost emisji w latach 70. XX w. odpowiedzialne były głównie obszary wsch. i środkowej Azji. Emisje SO2 w Europie wzrastały od końca XIX w., wskutek uprzemysłowienia i coraz większego zużycia węgla. Po roku 1945 szybko wzrastało zużycie ropy naftowej; emisje siarki podwoiły się w okresie od końca wojny do początku lat 70. XX w.
|
|
Dziś problem kwaśnych deszczów jest szczególnie istotny w Azji, gdzie emisje SO2 prawdopodobnie ulegną potrojeniu do roku 2010 w porównaniu z rokim 1990, jeśli aktualne trendy emisji i zużycia paliw nadal się utrzymają. Aby ograniczyć aktualne zniszczenia powodowane przez kwaśne deszcze w Azji i uniknąć znacznie gorszych szkód w przyszłości potrzebne są takie inwestycje w ochronę powietrza jakich dokonano w Europie i Ameryce Pn. w ciągu ostatnich 20 lat. Przykładowo, emisje SO2 w Europie zostały zredukowane o 44% w okresie 1990-1998. W tym samym czasie emisje NOx spadły o 21%. W USA i Kanadzie emisje SO2 spadły o 28% w latach 1980-1995.
|
|
Emisje koncentrują się w kilku regionach świata. Azja Wsch. dominuje w emisjach SO2, podczas gdy USA dostarcza największe ilości NOx.
|
|
Zajrzyj na inne strony Encyklopedii ESPERE:
Emisje wg sektorów gospodarki:
Klimat miasta - podstawy - część 1 - przyczyny
O wpływie kwaśnych deszczy na środowisko przyrodnicze, gospodarkę, oraz o obszarach szczególnie nimi zagrożonych:
Klimat miasta - więcej - część 3 - pochodzenie
Klimat miasta - podstawy - część 3 - wpływ 1
Klimat miasta - podstawy - część 3 - wpływ 2
Klimat miasta - podstawy - część 3 - obszary zagrożone
|
O tej stronie:
Autorzy: Anita Bokwa - Uniwersytet Jagielloński, Kraków i Elmar Uherek, Max Planck Institute for Chemistry, Moguncja, Niemcy
Konsultacja dydaktyczna: Michael Seesing, University of Duisburg, Duisburg, Niemcy
ostatnia aktualizacja: 2004-12-17
|
|
 |
|







